AJP:陈策实等乳腺癌Hippo信号通路研究获进展
2012-06-09 昆明动物所 昆明动物所
雌激素受体ER阴性乳腺癌是一种恶性程度比较高的乳腺癌类型,关于此类乳腺癌的信号通路研究一直是癌症研究领域长期未曾透彻解决的问题。近年来大量文章证实Hippo信号通路与乳腺细胞的增殖和凋亡有着重要关系。Hippo信号通路的下游主要通过YAP/TAZ共转录因子结合其它转录因子调控基因表达来实现,目前普遍认为YAP/TAZ结合的主要转录因子是TEADs以及含有PY序列的几个转录因子如Smads、RUNX

雌激素受体ER阴性乳腺癌是一种恶性程度比较高的乳腺癌类型,关于此类乳腺癌的信号通路研究一直是癌症研究领域长期未曾透彻解决的问题。近年来大量文章证实Hippo信号通路与乳腺细胞的增殖和凋亡有着重要关系。Hippo信号通路的下游主要通过YAP/TAZ共转录因子结合其它转录因子调控基因表达来实现,目前普遍认为YAP/TAZ结合的主要转录因子是TEADs以及含有PY序列的几个转录因子如Smads、RUNX2、p73和ErbB4。但是现有的证据不足以说明YAP/TAZ是通过这些转录因子促进细胞增殖和生存的。
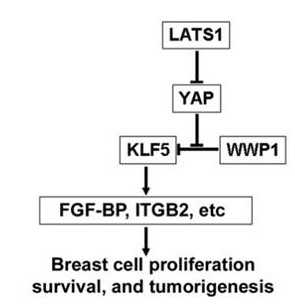
陈策实研究员领导的课题组的研究表明,促进细胞增殖和生存的干细胞转录因子KLF5是TAZ的重要合作伙伴,TAZ的WW结构域与转录因子KLF5的PY序列相结合,拮抗WWP1 介导的KLF5的蛋白降解,从而保护KLF5免受WWP1介导的泛素化降解,促进KLF5的下游基因表达、细胞增殖以及肿瘤生长(http://carcin.oxfordjournals.org/content/early/2011/10/31/carcin.bgr242.short)。这个工作今年早期已经发表在《Carcinogenesis》。但是YAP是否通过类似的机制行使功能还不清楚。
最近,昆明动物研究所肿瘤生物学实验室在陈策实研究员指导下,研究发现YAP与KLF5在ER阴性乳腺癌细胞系中共同表达,YAP的第二个WW结构域和KLF5的PY 序列相结合,保护KLF5被WWP1结合、泛素化和降解。从而诱导下游FGF-BP、ITGB2等基因的表达,最终促进乳腺细胞的增殖、存活、肿瘤生长。而抑制YAP活性的上游激酶LATS1也可以因此抑制KLF5-FGF-BP。重要的是,该研究显示抑制YAP和KLF5表达可以有效抑制ER阴性乳腺癌在动物体内的生长,提示它们是有效的抗癌药物靶点,针对这些新靶点的药物研发正在进行之中。
这项研究工作已于近日刊登在了国际癌症学刊物The American Journal of Pathology上,而且该研究得到自然科学基金-云南省联合重点项目、云南省高端科技人才项目以及中国科学院百人择优项目资助。(生物谷Bioon.com)

doi:10.1016/j.ajpath.2012.02.025
PMC:
PMID:
YAP Promotes Breast Cell Proliferation and Survival Partially through Stabilizing the KLF5 Transcription Factor
Xu Zhi⁎, †, Dong Zhao⁎, †, Zhongmei Zhou⁎, Rong Liu⁎, Ceshi Chen⁎, ,
The Yes-associated protein (YAP), an oncoprotein in the Hippo tumor suppressor pathway, regulates tumorigenesis and has been found in a variety of tumors, including breast, ovarian, and hepatocellular cancers. Although YAP functions through its WW domains, the YAP WW domain-binding partners have not yet been completely determined. With this study, we demonstrate that YAP functions partially through its binding to KLF5, a transcription factor that promotes breast cell proliferation and survival. YAP interacted with the KLF5 PY motif through its WW domains, preventing the E3 ubiquitin ligase WWP1 from ubiquitinating KLF5. Overexpression of the wild-type YAP but not the WW domain-mutated YAP up-regulated KLF5 protein levels and mRNA expression levels of KLF5 downstream target genes, including FGFBP1 (alias FGF-BP) and ITGB2. In addition, knockdown of YAP decreased expression levels of KLF5, FGF-BP, and ITGB2. Depletion of either YAP or KLF5 decreased breast cell proliferation and survival in MCF10A and SW527 breast cell lines, and stable knockdown of either YAP or KLF5 suppressed SW527 xenograft growth in mice. The YAP upstream kinase LATS1 suppressed the KLF5-FGF-BP axis, as well as cell growth through YAP signaling. Both YAP and KLF5 are coexpressed in estrogen receptor ERα-negative breast cell lines. These findings suggest that KLF5 could be an important transcription factor partner for YAP and may contribute to the Hippo pathway.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#Hippo信号通路#
56
#研究获进展#
65
#陈策实#
79
#信号通路#
0