Neuron:曾文文/周鸿团队发现肠道交感神经-L细胞单元通过调控GLP-1分泌影响机体血糖调控和大脑认知功能
2024-01-28 CellPress细胞科学 CellPress细胞科学 发表于加利福尼亚
研究揭示了肠道中存在的“交感神经-肠道L细胞”结构和功能单元,发现交感神经通过去甲肾上腺素(NE)-受体Adra2a信号轴抑制L细胞中GLP-1的释放,干扰机体血糖稳态,进而抑制葡萄糖在大脑中的利用,
机体血糖由体液和神经调节共同维持,二者通过网络协同作用实现血糖的常态性和瞬时性调控;而血糖代谢紊乱则会引发诸多健康问题。葡萄糖是大脑的主要能量来源,大脑中葡萄糖供应不足对学习和记忆产生不良影响。临床研究证实,葡萄糖代谢紊乱与2型糖尿病(T2DM)患者认知功能下降密切相关,同时也被认为是导致诸多神经系统疾病(如阿尔兹海默病,Alzheimer's disease,AD)恶化的关键因素之一。尽管代谢改变和脑功能障碍之间的紧密联系早已被关注,但我们对中枢与外周的连接,以及外周神经活动如何调节大脑认知功能仍然知之甚少。
肠道是维持能量平衡的关键器官之一,同时也被认为是体内的大型内分泌器官。在其分泌的肽类激素中,胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)在葡萄糖稳态调控中发挥重要作用。GLP-1 主要从肠道 L 细胞释放,之前研究认为其通过促进胰岛素释放等诸多方式改善血糖。在临床实践中,GLP-1已成为降糖/减重领域的明星分子,同时在心血管和认知功能等方面展现出多重获益,因此GLP-1也被评为2023年度《科学》十大突破之首。然而,参与调节内源性GLP-1分泌的因素和途径,以及对中枢的影响仍不完全清楚。
2024年1月18日,清华大学免疫所、医学院曾文文与上海交通大学医学院附属仁济医院周鸿主任医师合作,在Cell Press细胞出版社期刊Neuron发表题为“Sympathetic nerve-enteroendocrine L cell communication modulates GLP-1 release, brain glucose utilization and cognitive function”的新成果。研究揭示了肠道中存在的“交感神经-肠道L细胞”结构和功能单元,发现交感神经通过去甲肾上腺素(NE)-受体Adra2a信号轴抑制L细胞中GLP-1的释放,干扰机体血糖稳态,进而抑制葡萄糖在大脑中的利用,影响认知功能。该发现为深入理解“外周交感神经-内分泌轴”的调控机制、丰富“Brain-Body Interface”交互网络以及拓展GLP-1的临床治疗策略奠定了重要的理论基础。

在这项研究中,为了探究神经系统与肠道内分泌细胞之间潜在的互作关系,首先使用免疫荧光染色和全组织染色检测二者的空间位置。结果显示,在小鼠和人肠道组织中,肠道L细胞(GLP-1标记)都与交感神经(TH标记)呈现密切空间关系。同时,在GLP-1与神经纤维标记物PGP9.5和TUJ1共染中,肠道L细胞也呈现出紧邻神经纤维的分布趋势,提示肠道L细胞可接受神经信号的调控,成为串联体液调节与神经调节的桥梁。
接下来,为了探究这一结构单元的功能特性,首先对小鼠的交感神经系统进行活性调控。化学遗传学激活的ThCreERT2;hM3Dq小鼠在口服葡萄糖耐受量检测试验(OGTT)中出现异常的血糖升高;ELISA和肠道组织免疫荧光染色显示出L细胞内的GLP-1的释放受到抑制;并且GLP-1R激动剂Exendin-4可极大地抑制交感神经激活后血糖上升的现象。后续,研究在NE合成缺失的ThCreERT2; Dbhfl/fl小鼠中获得了与之一致的结论。进一步,研究采用了腹腔神经节切除术(CGX)、化学性交感神经阻断术、结直肠的光遗传操纵、肠壁内AAV定点注射、组合病毒方式(肠壁内AAV定点注射+CG-SMG内AAV 注射)以及特定脑区立体定位注射等技术手段,对肠道交感神经在时空上进行了更为精准地调控。结果均显示,肠道区域性交感神经通过调控L细胞中GLP-1的分泌影响机体血糖稳态。
在明确了肠道交感神经作为上游的信号来源后,研究开始探究下游肠道上皮中肾上腺素能受体在转导交感神经信号输入方面的功能。研究对小鼠肠道上皮的肾上腺素能受体家族成员表达谱进行了检测,发现其高表达Adra2a受体;单细胞数据分析显示在小鼠和人的肠道L细胞中表达Adra2a/ADRA2A受体。进一步,利用Adra2a受体拮抗剂和肠道上皮特异性敲除Adra2a受体的小鼠(VilCre;Adra2afl/fl)进行研究,发现肠道上皮Adra2a信号的特异性抑制/缺失通过促进L细胞中GLP-1的释放提高了机体对葡萄糖的耐受性,并且在高脂高糖饲料诱导的高血糖模型中仍然对小鼠起到了保护作用。此外,研究进一步验证了“NE – Adra2a – Gi – pCaMKII - Ca2+”信号通路在GLP-1释放中的分子调控机制。
最后,研究探索了这一外周神经-内分泌调控单元对中枢的影响。首先利用小动物PET/CT观测小鼠大脑中葡糖糖的摄取情况,结果显示,在VilCre;Adra2afl/fl小鼠和注射了Exendin-4的野生型小鼠中,血液中的18F-FDG均可被大脑更快地摄取;糖酵解的代谢流检测也印证了VilCre;Adra2afl/fl小鼠大脑中的葡萄糖被更快地利用。借助光声显微成像系统,发现通过外周激活GLP-1R信号可显著增加大脑中的血氧饱和度,并观测到显著的脑血管舒张现象,表明外周来源的GLP-1可能通过调节血管舒张增加向大脑中转运能量物质和氧气的速率以提高大脑中葡萄糖的利用效率,进而影响大脑功能。接下来,利用水迷宫检测了小鼠的空间记忆能力,发现抑制肠交感神经-L细胞单元可提高小鼠的记忆能力,并且这一过程依赖于GLP-1的参与。
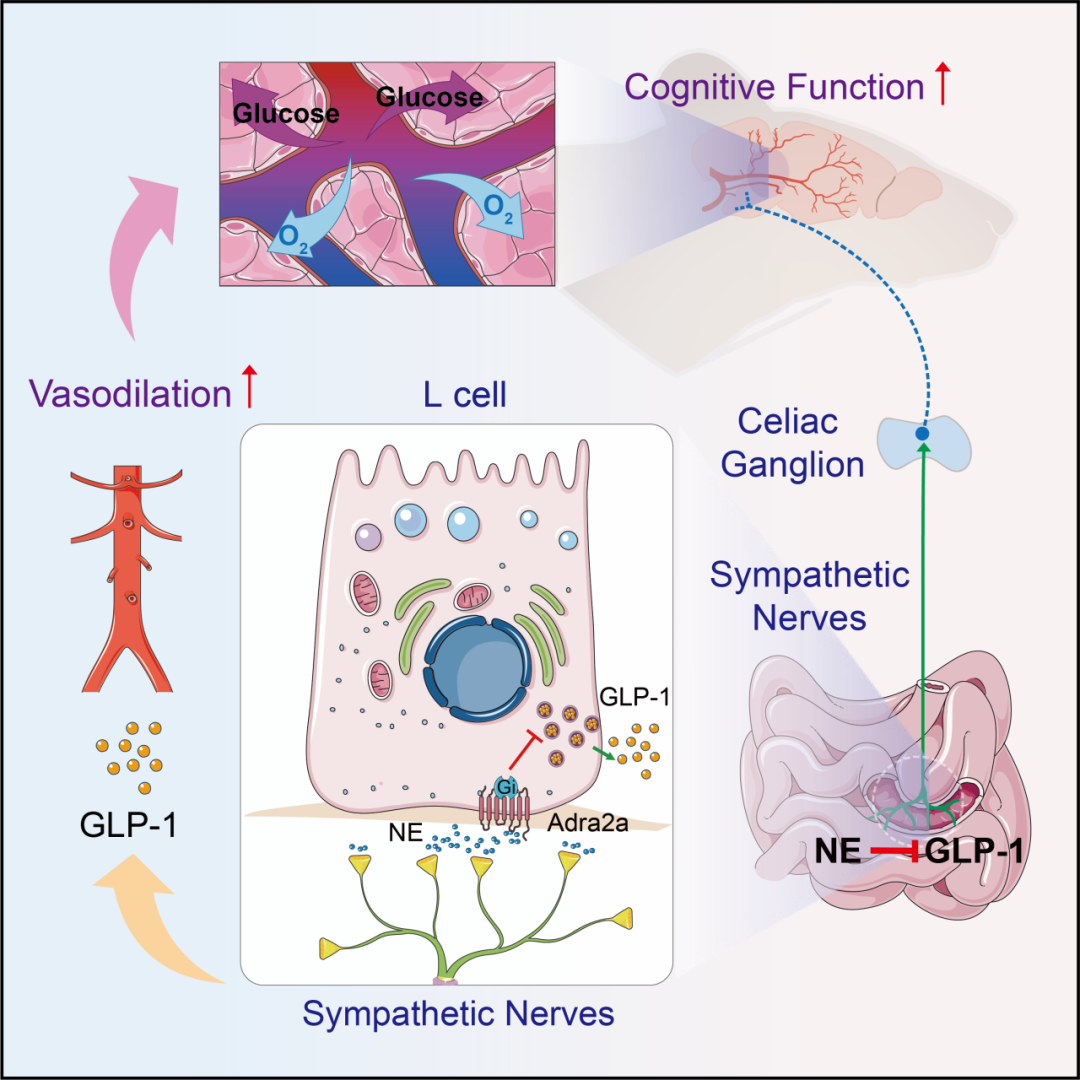
综上,这项研究发现了一种全新的肠道交感神经-内分泌轴,并阐述了其通过抑制GLP-1分泌实现对血糖和认知功能的调控,为动员肠道分泌内源性GLP-1治疗代谢疾病及相关认知障碍的临床策略提供了潜在靶标。
清华大学免疫所、医学院曾文文教授和上海交通大学医学院附属仁济医院周鸿教授为本文共同通讯作者。清华大学医学院、免疫所博士生任文冉为该文第一作者,清华大学医学院博士生陈建辉、李庆庆提供了关键数据,仁济医院王文静、殷霞、庄光磊为本研究作出了重要贡献。研究获得了国家自然科学基金、国家重点研发计划、北京市自然科学基金、清华大学医学院、免疫所和生命科学联合中心的支持。
原始出处:
Sympathetic nerve-enteroendocrine L cell communication modulates GLP-1 release, brain glucose utilization and cognitive function, https://www.cell.com/neuron/fulltext/S0896-6273(23)00971-6 https://doi.org/10.1016/j.neuron.2023.12.012
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言















#GLP-1# #交感神经# #血糖调控# #肠道L细胞#
130