国际前沿研究:中位生存期只有15个月,丘脑胶质母细胞瘤患者的未来在哪里?
2022-08-07 INC国际神经科学 INC国际神经科学
国际丘脑胶质母细胞瘤病例分享。
什么是丘脑?丘脑又称背侧丘脑,是间脑中最大的卵圆形灰质核团,位于第三脑室的两侧,左、右丘脑借灰质团块(称中间块)相连。丘脑位置深在、靠近功能区,有许多重要的神经核团,加上其本身及周围结构重要、复杂,丘脑位置的手术有肢体瘫痪、感觉障碍等风险大。由于位置深在且毗邻重要功能区,丘脑肿瘤手术切除一直是神经外科的难题。
欧洲、美国以及中国新版的治疗规范都指出,治疗脑肿瘤,手术是首选和基本的治疗方案,应寻求适合的最佳手术入路,保障首次手术全切。手术在保护好周围正常脑组织的同时,切除率越大,患者长期生存的可能性越高。对于胶质母细胞瘤也是如此,已有很多研究证实了最大程度的手术切除在治疗胶质母细胞瘤中的重要性,然而,丘脑胶质母细胞瘤的最大切除却很少尝试,其作用仍不清楚。在传统丘脑胶质母细胞瘤的治疗中,经常进行活检以确认病理诊断和分子特征,而手术切除仍然具有挑战性。
2021年2月新近发表的论文《Maximal surgical rep and adjuvant surgical technique to prolong the survival of adult patients with thalamic glioblastoma》中通过临床研究以及真实案例证明了最大程度手术切除在成人丘脑胶质母细胞瘤(GBM)治疗中的作用,并确定最大安全切除的手术技术所产生的影响。

论文截图
案例一
68岁男士丘脑GBM获次全切,
术后4年多未复发
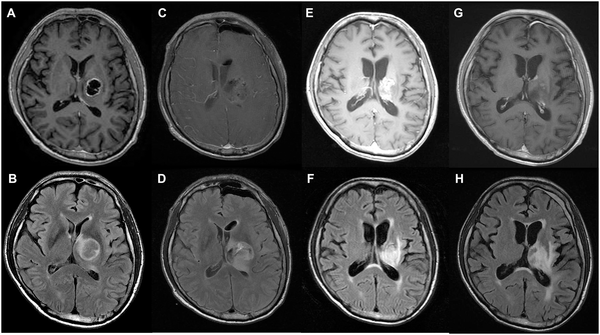
一名68岁男性因头痛和视力模糊入院。术前磁共振成像(MRI)显示外侧丘脑病变中的囊性和实性肿块,增强强化,提示胶质瘤。术后MRI显示肿瘤大体切除(C)、肿瘤次全切除(D)。在一年的随访MRI中,T1增强图像(E)中有不规则和模糊的增强,T2-FLAIR图像(F)中有高信号。在2年的随访MRI中,T1对比增强图像(G)和T2-FLAIR图像(H)处于稳定状态。患者健在,术后生存时间为1515天。

案例二
52岁丘脑GBM女士,
次全切后4年未复发,生活如常
一名52岁女性,因神志不清、复视、运动无力入院。术前磁共振成像(MRI)显示:下丘脑病变中的囊性和实性肿块。术后MRI显示T1增强图像上的肿瘤次全切除(C、D)。在一年的随访MRI中,T1-对比增强图像(E)有不规则增强,T2-FLAIR图像(F)有高信号。在2年的随访MRI中,T1增强(G)和T2-FLAIR图像(H)显示稳定状态。患者健在,术后生存时间为1469天。
丘脑胶质母细胞瘤治疗策略
在怀疑丘脑胶质母细胞瘤的情况下,手术切除一般是首选治疗方法。如果可能,手术的目的是保留神经功能前提下全切除。在预期出现严重神经系统并发症、怀疑皮质脊髓束(CST)损伤或可能发生脑干损伤或血管损伤的情况下进行次全切除。活检是脑室壁强化、软脑膜强化或远处多发强化病变患者的治疗选择。病理诊断确诊后,本研究所有患者均接受胶质母细胞瘤标准治疗(同步放化疗和替莫唑胺化疗)。
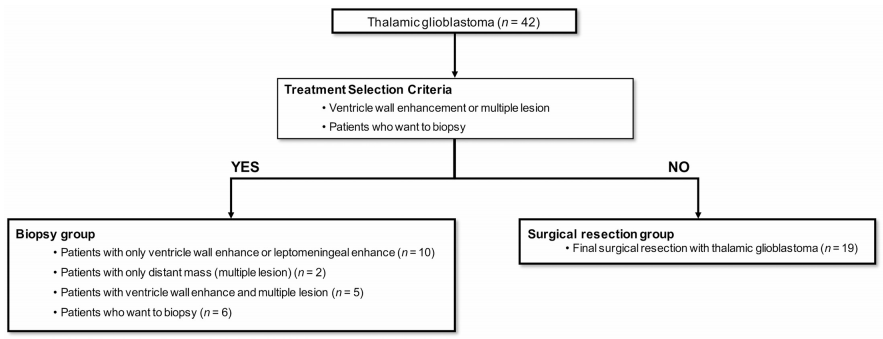
丘脑GBM的治疗策略和患者选择。对于疑似丘脑胶质母细胞瘤,手术切除是首选治疗方法。当脑室壁强化、软脑膜强化或远距离多发强化病灶时,考虑只活检手术。
辅助手术技术
术前导航MRI、弥散张量纤维束成像(DTI)、增强型计算机断层(CT)常规进行并融合在一起。在硬脑膜完全打开之前,导航棒(tailed bullet)通过小硬脑膜切口(<5 mm)的切口插入肿瘤靶标,其主要目标区域是皮质脊髓束和中脑,在手术过程中难以区分。在融合图像中标记了靶标插入的目标点。在手术过程中,使用这些靶标,能在显微镜下确认目标病变并将融合图像与目标点进行比较。由于手术过程中肿瘤体积缩小,肿瘤及其周围环境发生了改变;因此,术中进行CT以识别病灶相对于融合图像的变化。5-ALA用于区分所有手术切除病例中的肿瘤病变。经颅运动诱发电位(MEP)和单极直接皮层下刺激(DSS)用于确认术中功能状态和CST的位置。在整个皮层手术过程中,每5分钟以60~100mA监测经颅MEP。DSS以10 mA启动,并随着刺激器接近CST而降低至6mA。如果患者状态允许,则在患者清醒时进行清醒手术,以检查患者术中功能状态。
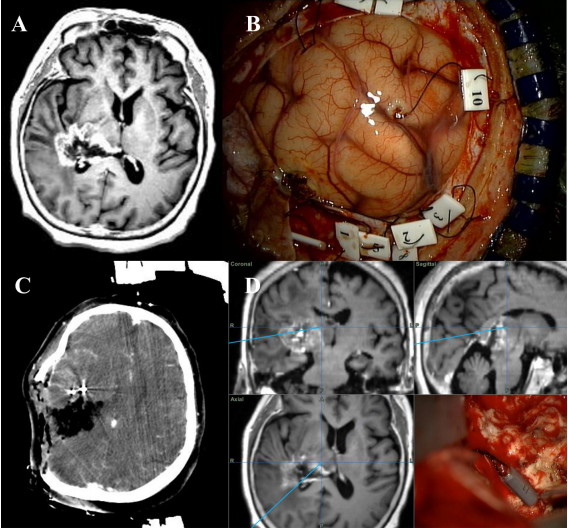
术中导航辅助手术技术:右后部胶质母细胞瘤的术前磁共振图像,侧向伸展的丘脑(A)。导航棒插入目标区域(B)。在操作过程中,术中计算机断层扫描图像和尾弹技术用于调整大脑转移和确认目标病变(C, D)。
手术入路
手术入路的选择是根据肿瘤中心的位置和相邻的皮质脊髓束。考虑到肿瘤侵犯的模式和形态方式和CST的位置,建议选择从皮质到肿瘤的最短手术通道。当肿瘤位于丘脑前外侧或后外侧并向上外侧方向延伸时,选择经皮质入路。当肿瘤位于后外侧丘脑时,选择经皮层-经脑室入路。当肿瘤位于丘脑内侧和后部时,选择了半球间经胼胝体入路,而外侧丘脑病变则选择了经外侧裂-经岛叶入路。对于丘脑后下部和内侧后下部病变,采用枕部经小脑幕入路。改良的外侧眶上(MLSO)入路用于治疗前丘脑肿瘤。
 临床结果
临床结果
为了评估手术切除与活检相比的临床疗效,有研究者们估计了三组之间总生存期(OS)和无进展生存期(PFS)的差异:手术切除(n=19)、医生选择的活检(n=17)和患者选择的活检(n=6)。手术切除组显示出良好的OS(中位数:676天,p=0.001)(下图A)和PFS(中位数:328天,p=0.001)(下图B)与所述活检组(医生选择活组织检查,位OS相比:240天,中位PFS:134天;选择活检的患者,中位OS:212天,中位PFS:118天)
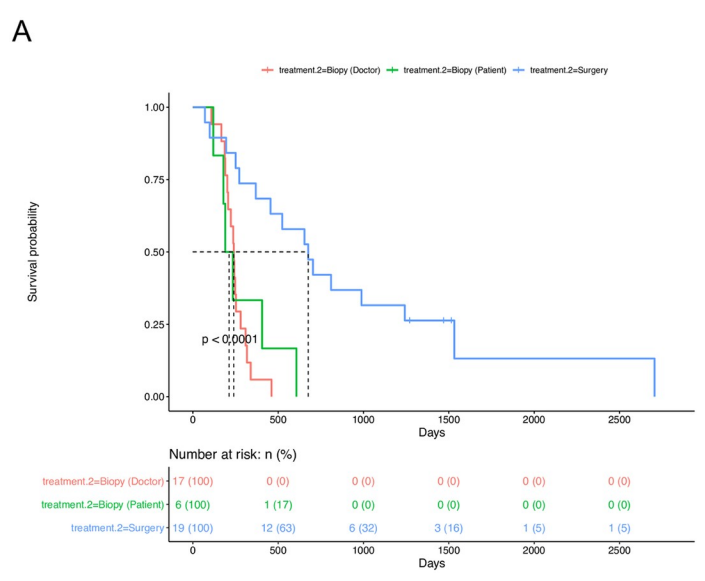
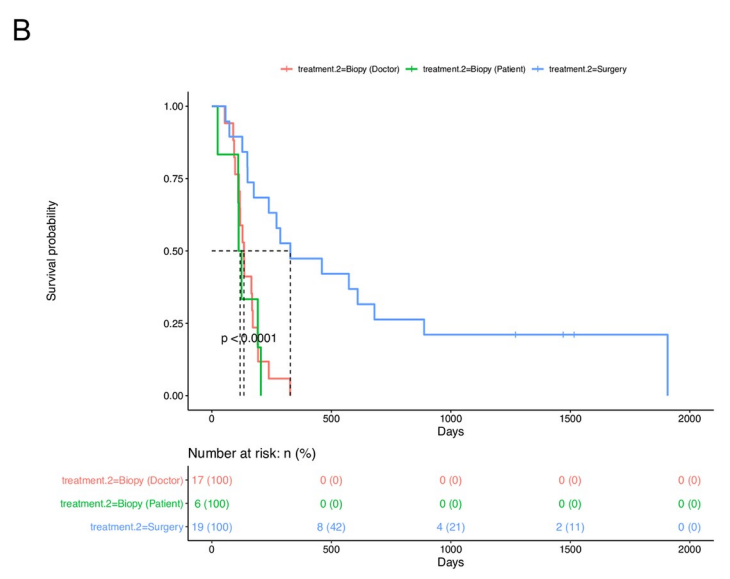
手术切除和活检组的生存分析。A. 接受手术的患者的总生存期 (OS) 显著更长,与根据治疗标准接受活检的患者(医生选择活检组)或选择活检的患者(患者选择活检组)相比,切除组p < 0.001。B. 手术切除组的无进展生存期(PFS)明显长于选择活检组的医生或患者选择活检组 (p < 0.001)。
此外,研究专家还表示,手术切除组与活检组在运动相关的神经系统并发症如运动无力、感觉障碍、视力障碍、认知恶化和KPS恶化方面无显著差异,当然该研究有显著的中心差异性,且案例数较少。

手术切除组和活检组之间手术和神经系统并发症的分布图
最后,研究得出结论,对于丘脑胶质母细胞瘤患者,选择合适的手术切除很重要。如果没有增强病灶或没有多发病灶,当最大手术切除率超过80%时,可以预期比单独活检有更长的生存期。使用一些高科技术中神经外科辅助设备可有助于更精准地切除肿瘤,且降低手术并发症发病率,通过仔细监测如MEP和DSS来检查神经生理状态很重要。
目前胶质母细胞瘤首先治疗手段是手术治疗,辅助以放化疗,手术切除程度是影响放化疗效果及生存期的最重要因素。如果是脑干胶母,手术难度极大,只有极丰富经验的医师才会建议病人手术。如果是多发胶母,肿瘤难以通过手术切除,只能做减压手术和放化疗为主。总之,具体的制定需要取决于肿瘤的情况和神经外科、神经肿瘤等学科专家的诊疗计划。

图自:frontiersin.org
INC国际教授丘脑胶母手术案例
术前情况:26岁男士,职业足球运动员,在一次足球比赛中出现头部轻微外伤后,当时不以为意只做简单包扎处理,近3个月来逐渐出现复视、肢体活动欠灵活、容易急躁,遂当地医院就诊。发现巨大丘脑占位并压迫脑干,当地医院表示,目前虽无明显肢体瘫痪症状,但是手术难度风险极大,有昏迷、失明 、术后瘫痪、感觉障碍等可能,且肿瘤切除率有限。后慕名求诊于INC德国巴特朗菲教授,获得咨询意见后转诊德国INI医院治疗。

术前MRI影像资料
手术情况:在神电生理监测下行右侧额叶旁开颅术和通过额叶纵裂经胼胝体入路,肿瘤次全切除。 手术顺利,历时4小时,无新发神经损伤。
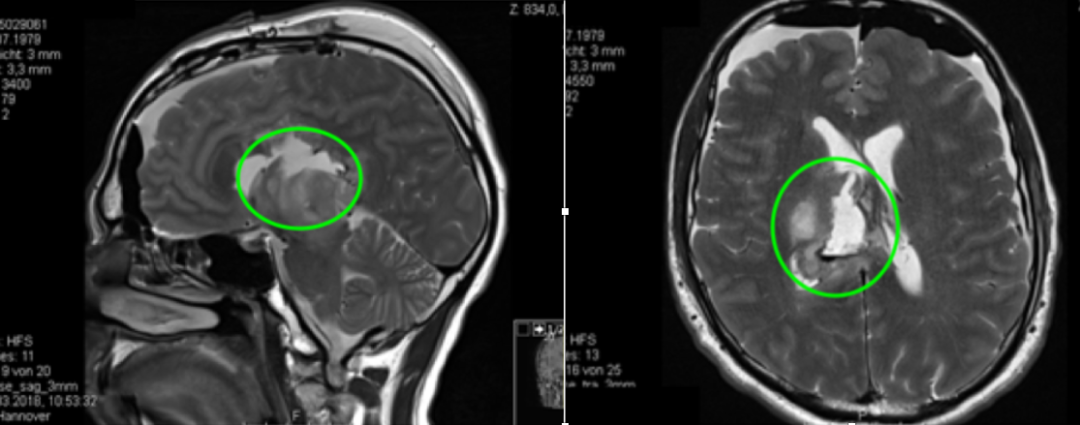
术后MR显示肿瘤次全切除,占位效应明显解除

术后病理:弥散性中线胶质瘤,H3 K27M突变型,WHO 4级
术后情况:术后第2天CT显示正常,第2天出ICU将其转到普通病房。出院时患者保持清醒,精神状态良好,没有颅神经缺损;没有视野缺陷,肢体感觉和运动正常。
胶质母细胞瘤七大前沿治疗技术
除了传统的手术、放化疗等治疗手段, 近几年,研究和临床试验更进一步发展,神经外科医生在临床诊疗时有了更多的治疗手段可供选择,患者也很大程度上缓解了病痛,拥有了更高的生存质量。INC世界神经外科顾问团成员教授、加拿大SickKids儿童医院脑瘤研究中心主任、世界神经外科专业知名杂志《Journal of Neurosurgery》主编James T. Rutka教授曾有诸多前沿研究,盘点总结了近年来胶质母细胞瘤七大前沿治疗。
1、靶向治疗:新型的靶向抑制剂,可以选择性地阻断从细胞膜乃至下游细胞信号转导通路上关键的效应分子,从理论上讲,各条细胞信号转导通路都能被特异性抑制。目前,针对恶性胶质母细胞瘤的分子靶向药物还处在临床前研究中。但是,多年的研究已证实,原癌基因(EGF和PDGF及其受体)和肿瘤抑癌基因与恶性胶质母细胞瘤发生、发展密切相关,另外,常见的1p、10p、10q、19q和22q杂合性缺失也影响恶性胶质母细胞瘤的基因表现型。这些已有的研究成功为恶性胶质母细胞瘤的分子靶向治疗提供了研究的靶点。
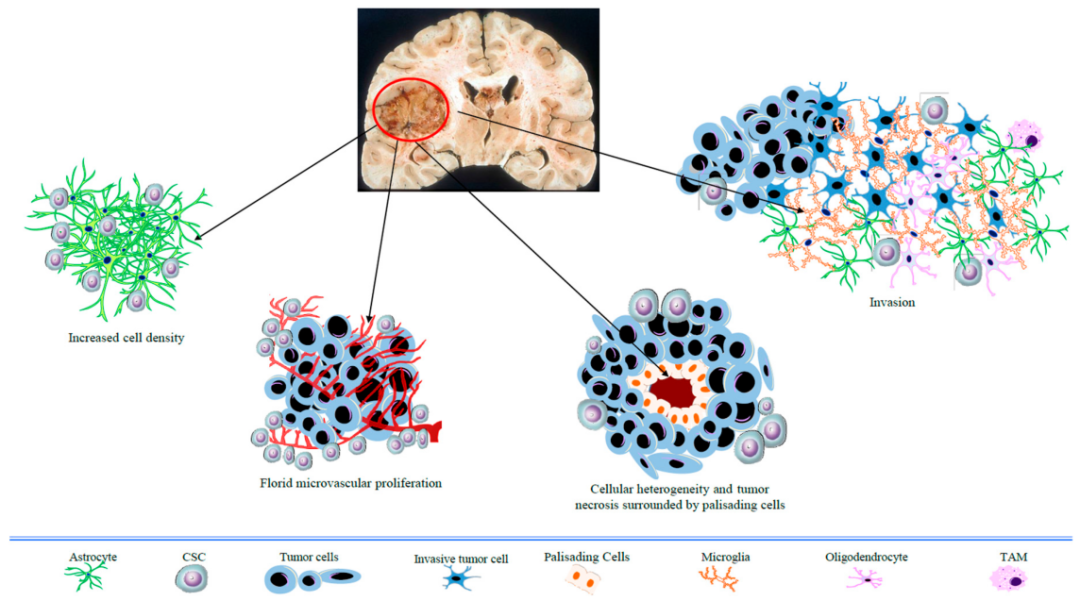
2、分子免疫治疗:胶质母细胞瘤被称为免疫性“冷”肿瘤,这是因为脑肿瘤含有很少的免疫细胞,大脑中存在着一种叫做血脑屏障的系统,会阻碍T细胞进入大脑组织。想要这些免疫细胞需要产生针对肿瘤的免疫反应非常困难。目前有几种有前景的溶瘤病毒和疫苗正在临床实验中。
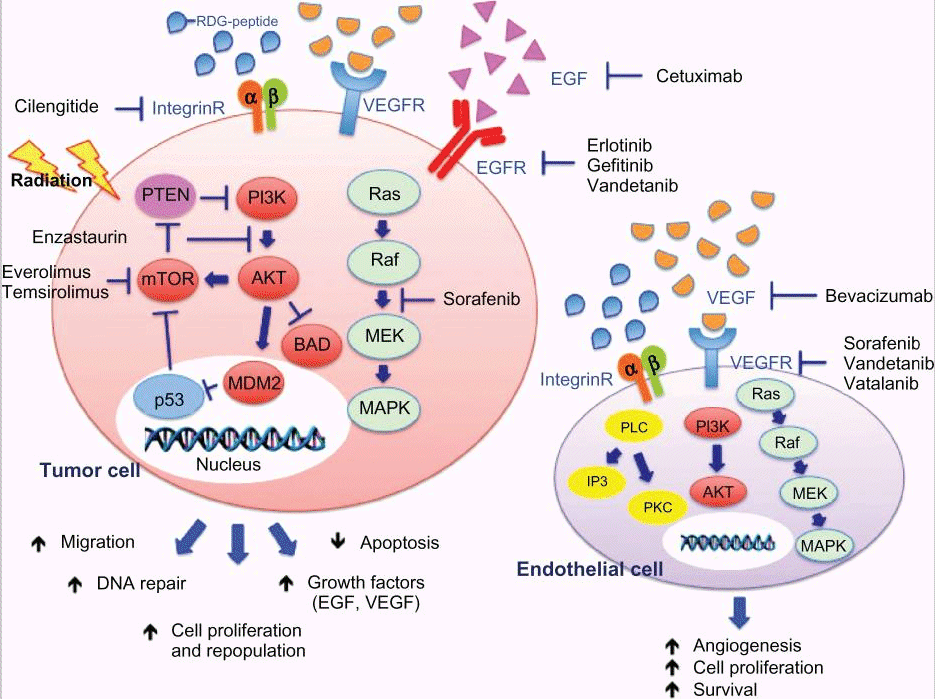
3、电场疗法:电场治疗是利用电场环境阻断细胞有丝分裂的过程,从而达到干预癌细胞增殖的作用。自从2015年FDA批准TTF疗法用于新诊断的胶母细胞瘤之后,电场疗法就一直为人所关注。在美国巴罗神经学研究所的一项大型临床试验中显示,电场治疗被证明可以延长肿瘤患者的生存期并保持生活质量。一项大型临床研究结果表明,将电场加入化疗的人比单独使用化疗的人有更长的生存机会。
4. 激光间质热疗LITT技术:2018年7月发表在Journal of Oncology(IF: 26)上的一篇LITT治疗胶质母细胞瘤的论文,验证了MRI引导的激光间质热疗法(LITT)对于某些患者的胶质母细胞瘤是安全有效的,与目前的标准治疗相比,平均寿命可延长2个月,对于像这样中位生存期只有12月左右的恶性肿瘤患者来说,这确是个不小的进步。

激光间质热疗(Laser Interstitial Thermal Therapy,LITT)是现代精准神经外科的产物,它是MRI磁共振下的一种经皮微创手术,依靠光纤传导近红外激光产生热能作用于靶点,从而选择性地消融病变组织。该技术最大优势在于,不用开颅即可在磁共振的实时引导和监测下,实现对脑深部病变和癫痫病灶的精准消融治疗。INC加拿大James T. Rutka教授曾多次在神外大会上分享了LITT技术的前沿进展和临床成功案例。教授在临床上的研究方向以儿童颅内肿瘤和癫痫为主,他精于清醒开颅术、显微手术,也是新兴的微创技术——激光间质热疗(LITT)的世界开拓者。值得一提的是,教授对于前沿科技的研究和运用一直走在世界前列,他所在的SickKids医院是较早一批拥有完整LITT技术设备的儿童医院。
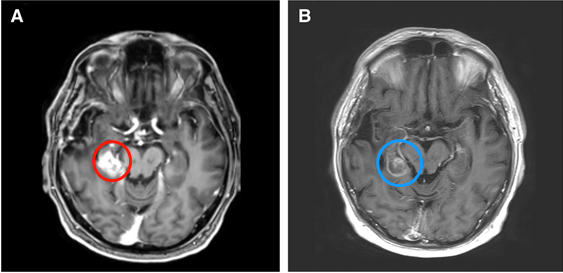
案例1:68岁男性,胶质母细胞瘤术后复发,LITT术消融前(A)和消融后(B)。请注意,消融区局限在周围的脑池,保护了邻近的脑干不受损伤。
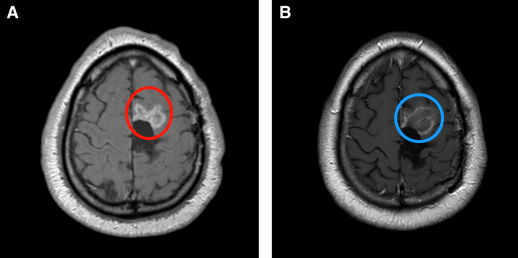
案例2:45岁男性,间变性少突胶质细胞瘤术后复发,LITT激光消融前(A)和消融后(B)。消融区向沿着中央前沟、避免了损伤初级运动皮层。

案例3:51岁男性,右颞丘脑胶质母细胞瘤术后复发,LITT消融前(A)和消融后(B)显示病灶得以毁损。
5. 纳米外科技术切除:过去三十年来,新技术新材料在手术室的应用已经带来了外科手术的进步和患者预后的改善。尤其是新技术的引入极大改善了癌症患者肿瘤切除率。INC世界神经外科顾问团成员教授、加拿大SickKids儿童医院脑瘤研究中心主任、世界神经外科专业知名杂志《Journal of Neurosurgery》主编James T. Rutka教授在其作为第一作者的《Nanosurgical Rep of Malignant Brain Tumors: Beyond the Cutting Edge》论文中解析了其手术团队在基因工程小鼠模型中使用手持式拉曼扫描仪探测及切除胶质母细胞瘤的可能性。他们表明手持式拉曼扫描技术可以准确检测到金二氧化硅表面增强拉曼散射(SERS)纳米粒子进入GBM,从而协助肿瘤精准完全切除。在神经外科的纳米技术方面中,研究展示了如何将新系统更好地应用于手术室,通过改变纳米颗粒的大小,克服血脑屏障带来的障碍,并使纳米颗粒结合物功能化,以便达到治疗目标。最后,通过对实际手持拉曼光谱技术本身的调整,人们可以设想有一天,“纳米外科”手术将成为外科医生装备的一部分。实验数据表明,术中SERS 导航手术切除肿瘤比使用手术显微镜和使用5-ALA技术衍生荧光导航切除术更有优势。相对于静态拉曼显微镜,手持拉曼扫描技术可以带来更好的速度进行术中数据采集,且可以提供术中实时操作指导,并且可用于任何角度的手术床。目前,有些手持式拉曼扫描技术已经在临床实践中使用,这有利于迅速推动纳米技术在神经外科手术中的应用。

6. 使用具有靶向递送增强作用的铂类纳米偶联物和磁共振引导聚焦超声治疗胶质母细胞瘤:INC加拿大James T. Rutka教授在其另一篇关于GBM的研究论文《Enhancing glioblastoma treatment using cisplatin-gold-nanoparticle conjugates and targeted delivery with magnetic resonance-guided focused ultrasound》中指出,胶质母细胞瘤 (GBM) 是最常见和最具侵袭性的原发性脑肿瘤,且具有越来越高的发病率和死亡率。迫切需要一种提高现有药物疗效并增强化疗药物通过血脑屏障递送的技术。作者研究了铂类纳米偶联物与磁共振引导聚焦超声结合以加强胶质母细胞瘤治疗效果。研究表明,与传统游离顺铂药物相比,铂类纳米偶联物极大地抑制了 GBM 细胞的生长,并显示出与放射治疗的显著协同作用。此外,在铂类纳米偶联物处理的细胞中观察到通过 γH2AX 磷酸化增加的 DNA 损伤,以及增加的铂浓度。在体内,铂类纳米偶联物大大抑制了胶质母细胞瘤肿瘤的生长,磁共振引导聚焦超声导致脑组织中血脑屏障通透性和铂类药物递送吸收的增强。我们的研究表明,铂类纳米偶联物和 磁共振引导聚焦超声可用于重点增强靶向化疗药物对脑肿瘤的递送。

7. 分子生物学基因治疗研究:自人类基因组计划完成以来,非编码 RNA (ncRNA)已成为一类重要的遗传调节剂。INC加拿大Rutka教授在《Noncoding RNAs in Glioblastoma: Emerging Biological Concepts and Potential Therapeutic Implications 》中讨论了ncRNA 在调节胶质母细胞瘤 (GBM) 形成和进展中的潜在作用,以及开发ncRNA在诊断和治疗GBM中潜能的策略。教授指出,在分子生物学时代,随着先进基因测序技术的发展,已经发现了几种不同类别的 ncRNA,包括 microRNA (miRNA)、非编码 RNA (lncRNA)、环状 RNA (circRNA) 和 piwi 相互作用的 RNA (piRNA),这些已被联系到许多重要的发育和疾病过程,并正在被作为临床和治疗靶点。

参考文献:https://doi.org/10.1371/journal.pone.0244325
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#母细胞瘤#
95
#胶质母细胞#
87
#生存期#
107
#细胞瘤#
95
#丘脑#
0
#丘脑#
74