失眠新药daridorexantIII期试验结果积极,显著改善睡眠质量
2020-04-24 MedSci MedSci原创
4月20日,瑞士制药公司Idorsia宣布,其候选药物双重食欲素受体拮抗剂daridorexant在针对失眠患者的首项关键性III期临床试验中表现积极,显著改善了患者的睡眠始发、睡眠质量和日间表现。与
4月20日,瑞士制药公司Idorsia宣布,其候选药物双重食欲素受体拮抗剂daridorexant在针对失眠患者的首项关键性III期临床试验中表现积极,显著改善了患者的睡眠始发、睡眠质量和日间表现。与以往研究不同的是,这次还评价了治疗失眠后的日间表现,这是传统治疗失眠药物会导致第二白天“宿醉”感,影响正常工作状态,一直被诟病。

图片来源:Idorsia官网
自20世纪90年代末,Idorsia就已着手开发daridorexant(此前被称为nemorexant),它是一种双重食欲素受体拮抗剂。食欲素是一种调节觉醒的神经肽,能够刺激多条导致觉醒的信号通路。Daridorexant通过阻断食欲素的功能抑制失眠症患者中过度活跃的觉醒通路。这与大多数睡眠药物(如苯二氮卓类药物)的作用机制不同,后者通过广泛镇静大脑,使患者第二天出现“宿醉”感,即由于药物在体内存留的浓度较高而导致的头晕、困倦、疲乏和定向障碍等。
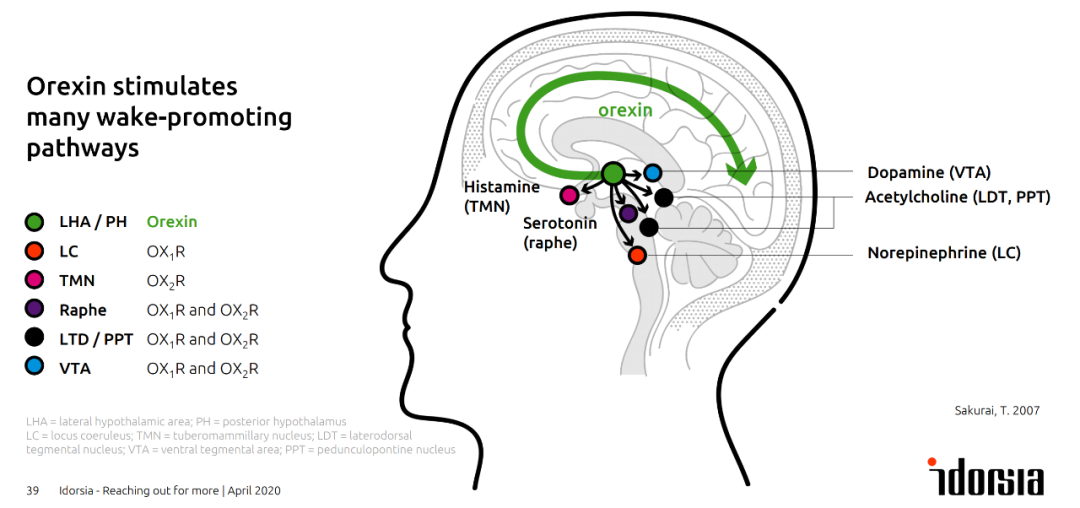
食欲素刺激多条促觉醒的信号通路(图片来源:Idorsia官网)
在此前2期的研究结果中,研究者选择成年人(≤64岁)失眠症受试者被随机化(1:1:1:1:1:1:1:1:1),每日口服安慰剂、daridorexant(5、10、25或50mg)或唑吡坦(zolpidem )10mg,共30天。主要的疗效结果是睡眠开始后醒来时间从基线到第1天和第2天的变化。次要的疗效指标为从基线到第1和第2天的持续睡眠潜伏期的变化,睡眠开始后主观觉醒时间的变化,以及从基线到第4周的睡眠开始的主观潜伏期。安全性也进行了评估。结果发现,1,005名受试者中,有359名(64%的女性)被随机化,并接受≥1的剂量。一个显著的剂量-反应关系(双侧P <0.001)发现,在减少睡眠开始后的唤醒和持久性睡眠的潜伏期,从基线到daridorexant的第1和第2天的持续睡眠的基础上,发现了显著的剂量-反应关系。这些减少持续到第28和29天(P = 0.050和P = 0.042,分别)。观察到类似的剂量依赖性的关系为睡眠开始后的主观觉醒和睡眠开始的主观潜伏期。在用5、10、25和50mg daridorexant治疗的受试者中,治疗引起的不良事件发生率分别为35%、38%、38%和34%,而安慰剂为30%,10mg唑吡坦为40%。没有临床相关的严重不良事件。4名受试者因不良事件而退出治疗。
三期注册计划包括两项为期3个月的确认性研究,以及一项为期40周的扩展研究,该研究从18个国家的160多个研究点招募了约1800名失眠患者(每项研究中的900名)。
此次公布的是第一个3期临床试验,共招募了930例成人(39.1% ≥ 65 岁)失眠患者,使用了两种药物剂量,25和50 mg。研究人员利用多导睡眠监测技术来测量入睡所需时间以及睡眠维持时间,即主要终点;总睡眠和日间表现为次要终点,通过采用睡眠问卷(Insomnia Daytime Symptoms and Impacts Questionnaire (IDSIQ))和睡眠日记来测量。在实施治疗后1个月和3个月进行分析显示,daridorexant显著改善了患者的睡眠始发和睡眠维持能力。IDSIQ是专门开发的问卷,不仅评价夜间睡眠状况,还能评价日间的状态。
安全性方面,在两种药物剂量下,安慰剂组和daridorexant组的不良事件发生率相当。在研究期间,25和50 mg daridorexant治疗组中均有37.7%的患者出现了治疗相关不良事件(Treatment-emergent adverse events ,TEAE),安慰剂组为34.0%。最常见的TEAE是鼻咽炎和头痛,发生率超过3%,高于安慰剂组。而相较于daridorexant治疗组(25 mg,2例;50 mg,3例),安慰剂组的严重不良事件数量更高(7例)。
此外,根据独立盲法评估,所有组中潜在的嗜睡样症状(该症状用于指示白天睡眠过度)是平衡的,且每天早晨通过视觉模拟量表对患者进行评估,均没有发现次日早晨有残留效应,同时,患者也没有出现反弹性失眠,或停药后的戒断症状,也未观察到自杀、自杀意念或自我伤害。显示药物具有重要的安全性和耐受性。
医学博士和Idorsia的首席执行官Jean-Paul Clozel,评论说:"虽然我们设计daridorexant是为睡眠药物设计的最佳方案,但我对结果感到震惊。一旦获得批准,通过为数百万失眠患者提供daridorexant,Idorsia将对这一医学、社会和经济问题产生重大影响。特别是在我们生活的这个禁锢的时代,睡眠问题是一个重大的问题,需要一个非常安全有效的药物,可以被许多人使用。有了这些成果,Idorsia进入了一个新的时代;成立不到3年,Idorsia正在向着成为一家成熟的生物制药公司的愿景迈进一大步。"
亨利-福特医院睡眠障碍与研究中心主任托马斯-罗斯博士评论说:"失眠症的药物治疗不仅要帮助患者快速入睡,保持睡眠,还要解决睡眠不好对白天功能的负面影响。我认为,实现这一目标的最佳方法是通过阻断奥曲肽的作用,从而降低失眠症患者中出现的过度清醒状态。这将使患者能够整夜入睡,同时避免了许多睡眠药物通过大脑的广泛镇静作用而产生的不良影响。在这项为期3个月的3期研究中看到的出色结果表明,daridorexant可以满足失眠症患者的这一重要需求。"
Idorsia首席科学官Martine Clozel博士说:"Daridorexant并不是偶然发现的,我们的研究团队自1998年首次对食欲素及其受体进行研究以来,一直非常努力地寻找一种双重拮抗剂。这种分子不仅要能够快速起作用,其作用持续时间还要有“夜间足够长、日间足够短”的特点,以避免在次日早晨残留任何负面的活性。今天我们分享的这项研究结果非常有价值,它证明了我们坚持了20多年的项目是正确的。"
医学博士、Idorsia全球临床开发负责人Guy Braunstein评论道:"在设计我们的方案时,我们必须显示出daridorexant对客观睡眠测量的效果。这对我们来说也是非常重要的,我们必须提供患者真正需要的东西。因此,该方案的目的是确定达利多松是否能改善患者对睡眠的感知和白天的表现。为了测量这一点,我们开发并验证了一个特定的患者报告结果工具。这是一个很大的承诺,我们有信心,如果有任何药物可以显示出积极的影响,那就是daridorexant。我们知道,这些信息是睡眠科学中缺少的。"
Guy Braunstein还补充道,"这项关键性研究的结果确实令人瞩目的是,在睡眠措施中获益的一致性。此外,这是第一个证明失眠产品可以改善患者白天感觉的研究。如果你问任何一个患有失眠症的人,这就是他们所希望的--睡得更久,白天感觉更好。Daridorexant就是在解决患者真正的问题。当你看到疗效在不影响安全性的情况下,效果更加显著。我们现在期待着Daridorexant 10和25毫克的第二项关键研究的结果。" Idorsia称,daridorexant第二个验证性III期研究(测量10、25和50 mg三种剂量,治疗时间也为3月)的结果预计在今年晚些时候公布。如果一切顺利,公司将于2020年底向美国FDA申请批准daridorexant。
第2项随机对照试验也是多中心、双盲、随机、安慰剂对照、平行组、多中心研究,评估了daridorexant对成人和老年失眠患者的客观和主观睡眠及日间表现参数的疗效和安全性。已公布结果的第1项3期研究评估了25毫克和50毫克剂量治疗3个月,而第2项研究将评估10毫克和25毫克剂量治疗3个月,预计将在2020年第三季度报告结果。
值得一提的是,Idorsia还将开展一项长达40周的扩展研究,以评估3种剂量daridorexant的疗效,获得该药长期治疗失眠患者的数据。期待这款疗法能够成为失眠症患者更好的选择。
据统计,全世界大约有30%的成人患有失眠,其中大部分人失眠症状会持续数月至数年。目前,全球已有两款食欲素受体拮抗剂被批准用于治疗失眠症患者,分别是默沙东的Belsomra(详细报道:默沙东失眠药Belsomra终于获FDA批准——如何突围成新的挑战)和卫材的Dayvigo(详细报道:失眠症治疗迎来曙光:FDA已批准卫材的Dayvigo)。
参考资料:
1. Dauvilliers Y, Zammit G, Fietze I, Mayleben D, Seboek Kinter D, Pain S, Hedner J. Daridorexant, a New Dual Orexin Receptor Antagonist to Treat Insomnia Disorder.Ann Neurol . 2020 Mar;87(3):347-356. doi: 10.1002/ana.25680
2. Idorsia’s Drug Improves Sleep in First Phase III Trial for Insomnia(来源:LABIOTECH.eu)
3. Idorsia announces positive results in the first Phase 3 study of daridorexant with improved overall sleep and daytime performance of patients with insomnia(来源:Idorsia官网)
4. Idorsia Company Presentation(来源:Idorsia官网)
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#IDO#
139
#II期试验#
114
#III#
59
#睡眠质量#
66
#III期#
65