罗氏公布IMbrave150研究主要终点全新结果:“T+A”方案可显著改善晚期肝癌患者总生存期,中国数据表现尤佳
2021-01-12 罗氏 罗氏
2021年1月12日,罗氏宣布即将在本月举行的美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)上正式报告IMbrave150研究总生存(overall survival, OS)最新结果。
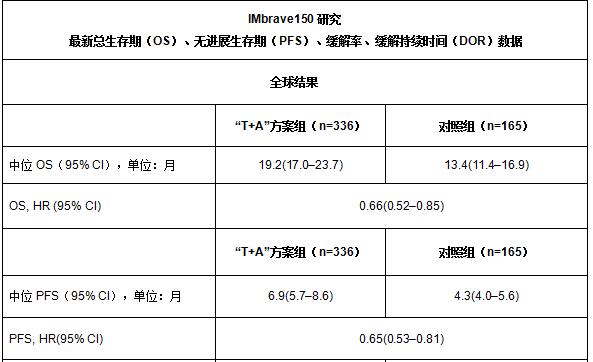
2021年1月12日,罗氏宣布即将在本月举行的美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)上正式报告IMbrave150研究总生存(overall survival, OS)最新结果。数据显示,接受泰圣奇®(Tecentriq®,通用名:阿替利珠单抗)联合安维汀®(Avastin®,通用名:贝伐珠单抗)免疫联合疗法(以下简称“T+A”方案)治疗的患者中位总生存期(mOS)为19.2个月,其中中国亚群患者的中位总生存期达到24.0个月。
IMbrave150是一项全球性III期、多中心、开放性研究,旨在评估“T+A”方案对比索拉非尼在既往未接受过系统性治疗的不可切除肝细胞癌(HCC)患者中的作用。2019年11月,罗氏在欧洲肿瘤内科学会亚洲大会(ESMO-ASIA)上公布了研究首要结果,两大主要终点——总生存期(OS)和无进展生存期(PFS)都达到了具有统计学意义和临床意义的改善。同时,IMbrave150试验的高质量PRO结果显示“T+A”方案可使患者报告的身体及角色功能和关键症状的恶化明显延迟,显著改善患者生活质量。
在经过中位时长15.6个月的随访后,最新分析结果表明,“T+A”方案可降低死亡风险34%,中位总生存期(mOS)达到19.2个月,优于此前标准方案的13.4个月(HR=0.66; 95% CI: 0.52–0.85);在中国亚群中,中位总生存期达到了24.0个月,优于此前标准方案的11.4个月(HR=0.53; 95% CI: 0.35-0.80)。最新总生存数据和无进展生存期(PFS)、客观有效率(ORR)等与首要分析结果一致。其安全性也与此前单独用药已知安全性特征一致,未发现任何新的安全信号。
IMbrave150研究的中国主要研究者、中国临床肿瘤学会(CSCO)副理事长秦叔逵教授指出:“2020年10月,‘T+A’免疫联合方案已正式在中国获批,目前也已被多个国内外权威临床指南以最优证据级别、最高推荐等级列为推荐疗法,充分证明了这一联合治疗药物/方案的突破性意义。值得一提的是,IMbrave150试验及扩展试验中的中国亚群虽然有着更高的乙肝感染率,同时具有大血管侵犯/肝外转移,甲胎蛋白≥400ng/ml等多种预后不良因素,仍然取得了出色的疗效,尤其是中位总生存期达到24.0个月,实现了晚期肝癌治疗的新突破,对中国广大患者而言具有里程碑式的重要意义!”
罗氏制药首席医学官、全球产品开发负责人Levi Garraway博士表示:“数据证实,在现有不可切除肝细胞癌的一线用药III期临床试验中,‘T+A’方案显示出了最长的总生存期。目前,该方案已在全球60多个国家和地区获批,结合首要分析结果,‘T+A’可为患者带来生存和生活质量的双重改善,是肝细胞癌治疗的重大进步。”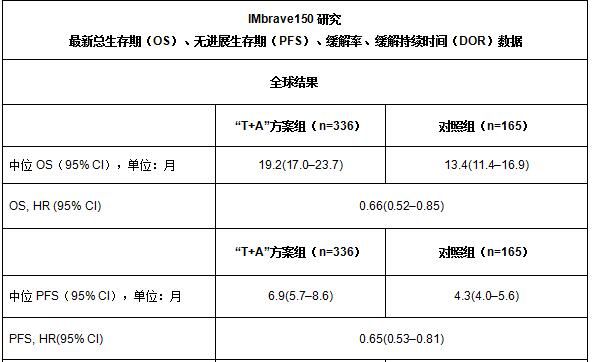

对照组:索拉非尼
PFS和所有缓解数据均由独立审查机构根据RECIST v1.1评估后报告
中位随访时间:15.6个月
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










阿替利珠单抗)联合安维汀®(Avastin®,通用名:贝伐珠单抗)免疫联合疗法(以下简称“T+A”方案)治疗的患者中位总生存期(mOS)为19.2个月,其中中国亚群患者的中位总生存期达到24.0个月。
121
#肝癌患者#
69
#主要终点#
84
赞
124
#肝癌#的T+A方案是比较巧妙的组合,与前期的乐伐替尼+K药相比,更经济实惠。
232
#生存期#
60
#总生存期#
75
肝癌,接下来就要细分了,对于体质好的病人,能否将PD-1类+抗血管新生+放疗等相结合,甚至有必要用TACE进行减负
99