百时美向FDA提交丙肝新药NDA
2014-04-08 tomato 生物谷
百时美施贵宝(BMS)4月7日宣布,已向FDA提交了实验性丙肝药物daclatasvir(DCV)和asunaprevir(ASV)的新药申请(NDA),daclatasvir是一种实验性NS5A复制复合物抑制剂,asunaprevir则是一种实验性NS3蛋白酶抑制剂。NDAs中所包含的数据,支持了丙肝鸡尾酒疗法(全口服方案,daclatasvir+asunaprevir,即DCV+ASV)用于基
百时美施贵宝(BMS)4月7日宣布,已向FDA提交了实验性丙肝药物daclatasvir(DCV)和asunaprevir(ASV)的新药申请(NDA),daclatasvir是一种实验性NS5A复制复合物抑制剂,asunaprevir则是一种实验性NS3蛋白酶抑制剂。NDAs中所包含的数据,支持了丙肝鸡尾酒疗法(全口服方案,daclatasvir+asunaprevir,即DCV+ASV)用于基因型1b丙型肝炎(HCV)的治疗。此外,DCV的NDA,也寻求批准daclatasvir与其他制剂联合用于多种基因型HCV的治疗。目前,欧洲药品管理局(EMA)正在审查daclatasvir的上市许可申请(MAA),同时daclatasvir和asunaprevir的NDAs也正在接受日本监管机构的审查。
此前,FDA已授予丙肝鸡尾酒疗法(DCV+ASV)突破性疗法认定。而去年,鸡尾酒疗法(全口服3DAA方案,DCV/ASV/BMS-791325)也获得了突破性疗法认定,百时美计划于2015年第一季度向FDA提交3DAA方案的监管文件。
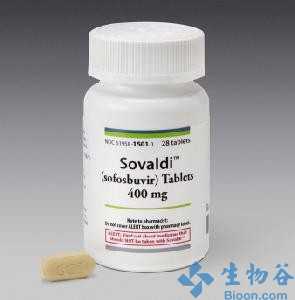
目前,丙肝治疗领域竞争十分激烈。吉利德(Gilead)开发的丙肝新药Sovaldi(sofosbuvir)已于2013年12月和2014年1月获FDA和欧盟批准,该药是首个获批可用于C型肝炎全口服治疗方案的药物,在用于特定基因型慢性丙型肝炎治疗时,可消除对传统注射药物干扰素(IFN)的需求。同时,吉利德已于2014年2月向FDA提交了鸡尾酒疗法(ledipasvir/sofosbuvir)的监管文件。
此外,艾伯维(AbbVie)也正在稳步推进其丙肝鸡尾酒疗法,今年3月公布的数据表明,该公司开发的丙肝鸡尾酒疗法(ABT-450/ritonavir/ABT-267/ABT-333)对基因型1b丙型肝炎的治愈率几乎达到了100%。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#百时美#
54
#丙肝新药#
72
#NDA#
59