PNAS:科研人员发现癌细胞“逃脱”免疫系统追击的新靶点NLRC5
2016-05-15 佚名 生物通
在正常情况下,免疫系统可识别并成功对抗癌细胞,从而随着它们的发展消除它们。然而,有时候这个过程会发生故障,从而形成肿瘤,现在,我们知道了其中的原因。美国德克萨斯农工大学健康科学中心的研究人员发现,当癌细胞能够阻止一个基因(被称为NLRC5)的功能时,它们就能够逃避免疫系统,并进行增殖,相关研究结果发表在5月9日的《PNAS》杂志。 本文通讯作者、德克萨斯农工大学医学院的Koichi Koba

在正常情况下,免疫系统可识别并成功对抗癌细胞,从而随着它们的发展消除它们。然而,有时候这个过程会发生故障,从而形成肿瘤,现在,我们知道了其中的原因。美国德克萨斯农工大学健康科学中心的研究人员发现,当癌细胞能够阻止一个基因(被称为NLRC5)的功能时,它们就能够逃避免疫系统,并进行增殖,相关研究结果发表在5月9日的《PNAS》杂志。
本文通讯作者、德克萨斯农工大学医学院的Koichi Kobayashi教授指出:“我们发现了癌细胞逃避我们免疫系统并形成肿瘤的主要机制。”这一结果表明,NLRC5可作为癌症病人生存和治疗反应的一个新型生物标志物,也是新疗法的一个潜在靶标。
Kobayashi说:“癌细胞就是因为基因变化而产生的,如基因突变或不同染色体的重组。正因为如此,所有癌细胞都有新的‘外源’基因,通常宿主T细胞将其检测为肿瘤抗原。这种抗肿瘤系统运行得非常好。”
Kobayashi和他的同事们在几年前发现,NLRC5可调节主要组织相容性复合体(MHC) I类基因。这些基因编码细胞表面的分子,呈现外来蛋白质的片段——例如来自病毒或细菌的蛋白。这些蛋白片段可通知一部分免疫系统,称为细胞毒性T细胞,从而引发来自免疫系统的一种即刻反应,对抗这种特定的外来抗原。
这项研究的新发现在于,相同的系统应该努力摧毁癌细胞,但有时它们能找到一种方法来禁用NLRC5基因,从而使它们逃避免疫系统,并形成肿瘤。该论文的第一作者、Kobayashi实验室的Sayuri Yoshihama博士指出:“如果MHC I类抗原呈现并不起作用,癌细胞将不会被T细胞杀死。我们发现,在癌症中各种机制减少了NLRC5的功能和表达,结果是,肿瘤细胞的免疫逃避。”
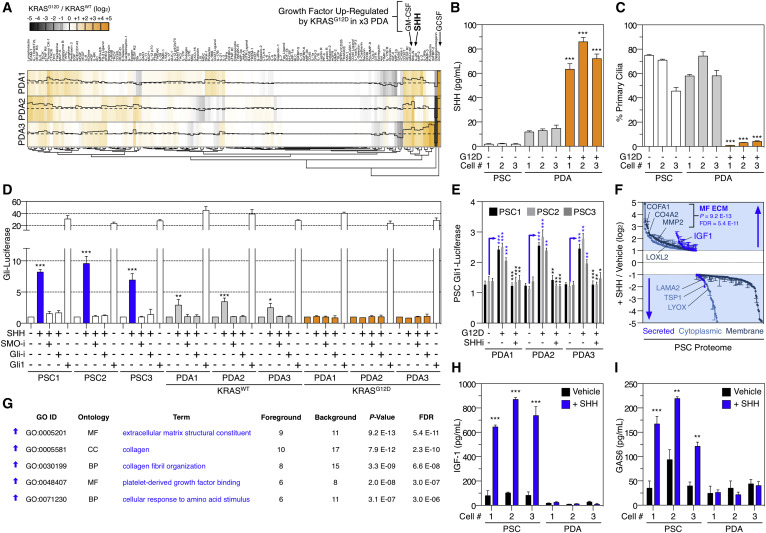
事实上,基于The Cancer Genome Atlas (TCGA)数据库中7747份实体肿瘤患者的活体组织检查,这个NLRC5基因的表达,是与各种癌症患者的生存率高度相关的,特别是黑色素瘤、直肠癌、膀胱癌、宫颈癌和头颈癌,生存时间更长的患者倾向于有更多的NLRC5表达。其中,黑素瘤和膀胱癌表现出最显着的差异,NLRC5低表达的患者组,5年存活率为36%,而在NLRC5高表达的患者组中,这个比例为34%。
Kobayashi说:“有了NLRC5作为癌症的一个重要生物标志物,我们最终可以预测癌症患者可以存活多久,以及癌症治疗对他们的效果如何。”这可能对黑色素瘤患者有重要的意义,因为NLRC5变异率相对较高,并且,因为它的表达水平,能够高度预测这种癌症患者的生存率。
该研究小组计划继续研究NLRC5在癌症中的作用,积极发展这一成果相关技术的商业化。临时专利申请已经提交,并基于NLRC5表达水平开发和验证一种测试,用来预测癌症患者的生存率和治疗反应,目前这些工作正在进行当中。希望在于,这种测试将为卫生保健提供者增添一种工具,用于确定癌症患者的最佳治疗策略,以消除昂贵的无益疗法的负担。
最终,Kobayashi和他的团队希望,这一发现也可能给癌症带来新的治疗策略。Kobayashi说:“如果我们能调节NLRC5的激活或其表达水平,这可能是一种新型的癌症疗法。几年来,我们希望我们的研究可以确定潜在的候选药物,可以增加NLRC5的水平,从而帮助我们自身的免疫系统来更好地对抗癌症。”不过,他提出了谨慎的建议。这种逃避免疫系统的机制,不是被每个癌症细胞利用,该研究仍然需要在动物模型中进行复制。
癌症并不是唯一受免疫系统影响的奇怪疾病。Kobayashi之前在免疫功能和遗传学方面的研究,都集中在炎症性肠病,如克罗恩氏病。他们也致力于移植医学研究,试图确定为什么一些器官被新的宿主排斥。
Kobayashi说:“我们现在知道为什么癌细胞可以逃离我们的免疫系统。没有其他的机制如同我们发现的机制一样引人注目。我们设想NLRC5生物标志物可让医生评估和确定每名癌症患者的最佳治疗策略,从而为每年1200万被诊断出患有癌症的人,带来更好的治疗效果。”
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#PNAS#
62
拜读,好文
80
#科研人员#
65
如果能用于实际就好了
139
#癌细胞#
81
#新靶点#
47
#NLR#
66