Lancet Haematol:初治Burkitt淋巴瘤R-CODOX-M/R-IVAC对比DA-EPOCH-R的3期研究结果
2023-11-26 聊聊血液 聊聊血液
该研究250例患者,但因入组率慢而提前终止,近日《Lancet Haematology》发表了研究结果,彼时两组分别可分析43例和41例患者。
Burkitt淋巴瘤
Burkitt淋巴瘤是一种罕见的侵袭性B细胞肿瘤,无高危因素(如高乳酸脱氢酶[LDH]、WHO体能状态评分≥2分、III期或IV期或肿块≥10cm)的低危成人患者的2年总生存率高达100%,而有高危因素的患者2年总生存率为70-75%,需要进一步改善治疗。但由于罕见性仍缺乏前瞻性临床试验,只有一项随机对照试验,其报告了利妥昔单抗加入高强度化疗骨架方案的附加价值,且现在利妥昔单抗已加入2期试验评估的所有高强度化疗方案中,包括剂量改良的R-CODOX-M/IVAC(利妥昔单抗、环磷酰胺、长春新碱、多柔比星、甲氨蝶呤、环磷酰胺、依托泊苷和阿糖胞苷)方案。
2013年发表了低强度方案的数据,即DA-EPOCH-R(剂量调整的依托泊苷、泼尼松、长春新碱、环磷酰胺、多柔比星和利妥昔单抗),与高强度化疗方案相比,该方案不强制住院。在这项单中心研究中,高危患者接受DA-EPOCH-R治疗的3年无进展生存率(PFS)为95%,在另一项多中心研究中4年无事件生存率为82%。
鉴于尚无随机对照试验比较不同的化疗方案,荷兰学者设计了HOVON/SAKK 127研究,在高危Burkitt淋巴瘤患者中比较了高强度R-CODOX-M/R-IVAC方案和低强度DA-EPOCH-R方案,旨在证实DA-EPOCH-R是否有较好的无进展生存期(这一结论是既往一项随机试验所报告)。该研究250例患者,但因入组率慢而提前终止,近日《Lancet Haematology》发表了研究结果,彼时两组分别可分析43例和41例患者。

研究方法
该研究者发起的国际多中心、开放标签、随机3期研究纳入18-75岁的新诊断(散发性和免疫缺陷相关) 高危Burkitt淋巴瘤(通过局部病理诊断);根据Mead等的文章定义高危疾病(LDH升高、WHO体力状态评分≥2分、III期或IV期或肿块≥10cm)。HIV阳性患者符合纳入标准(建议接受抗病毒治疗)。其他纳入标准包括WHO体能状态0-3分(仅当与疾病相关时,WHO体能状态可为4分)、充分的血液学、肾脏和肝脏实验室检查。排除CNS受累的患者,因为DA-EPOCH-R方案不含大剂量的CNS穿透性药物(如甲氨蝶呤和阿糖胞苷)。
患者1:1随机接受2个周期R-CODOX-M/R-IVAC方案或6周期DA-EPOCH-R方案。R-CODOX-M包括利妥昔单抗375 mg/m²第1天和第9天,环磷酰胺800 mg/m²第1天,环磷酰胺200 mg/m²第2-5天,长春新碱1.5 mg/m²第1天和第8天,多柔比星40 mg/m²第1天,甲氨蝶呤3000 mg/m²(年龄≤65岁的患者)或1000 mg/m²(年龄> 65岁的患者)第10天。R-IVAC包括利妥昔单抗375 mg/ m²第3天和第7天,异环磷酰胺1500 mg/ m² (≤65岁患者)或1000 mg/ m² (>65岁患者)第1-5天,依托泊苷60 mg/ m²第1-5天,阿糖胞苷2000 mg/ m² (≤65岁患者)或1000 mg/ m² (>65岁患者)第1天和第2天。DA-EPOCH-R包括剂量调整的依托泊苷50 mg/m²(50-124 mg/m²,取决于剂量水平)第1-4天,泼尼松龙120 mg/m²第1-5天,长春新碱0.4 mg/m²第1-4天,剂量调整的环磷酰胺750 mg/m²(480-1866 mg/m²,取决于剂量水平)第5天,剂量调整的多柔比星10 mg/m² (10-24 mg/m²,取决于剂量水平)第1-4天,利妥昔单抗375 mg/m²第1和5天。除口服泼尼松龙外,所有药物均为静脉给药。患者还接受了4次阿糖胞苷(70mg)和4次甲氨蝶呤(15mg)鞘内CNS给药,时机由医师选择。患者入院接受所有R-CODOX-M/R-IVAC治疗;如果可行则允许在门诊给予DA-EPOCH-R。
在前28例患者登记后研究方案进行修改,允许在随机分组前接受1个周期的R-CHOP治疗。最初的R-CHOP旨在改善症状严重的Burkitt淋巴瘤的临床病程,并促进纳入试验,因为疾病负担和症状,导致部分患者在纳入和随机分组之前必须治疗。
主要终点为PFS,次要终点包括治疗结束时的缓解率、总生存期(OS)、无事件生存期(EFS)、疾病特异性生存期、安全性和住院时间(过夜)。
研究结果
患者
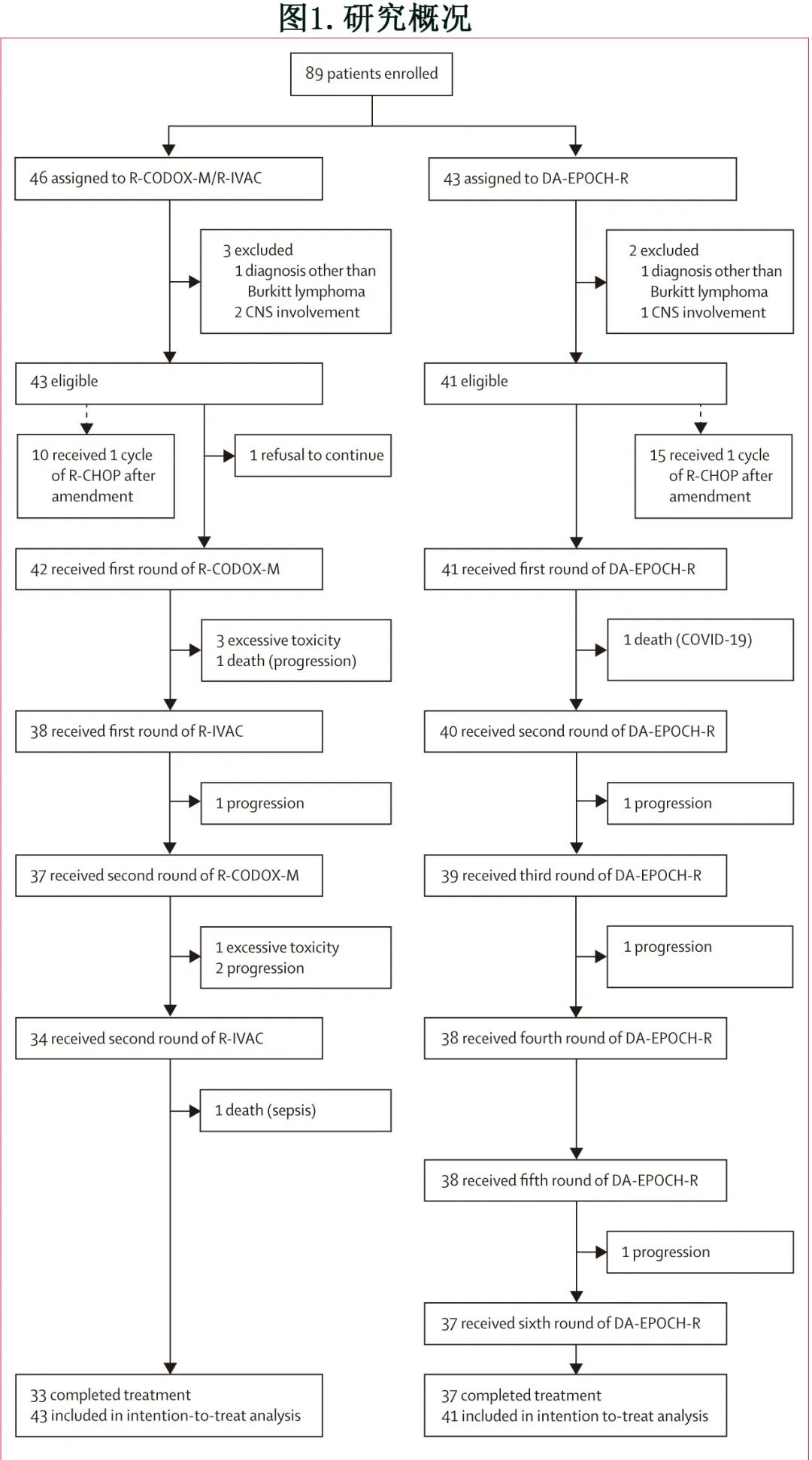
R-CODOX-M/R-IVAC 组入组46例患者,DA-EPOCH-R组有43例患者(图1),其中5例(分别有3例和2例)因各种原因在随机后排除,其余84例患者纳入改良意向治疗分析。
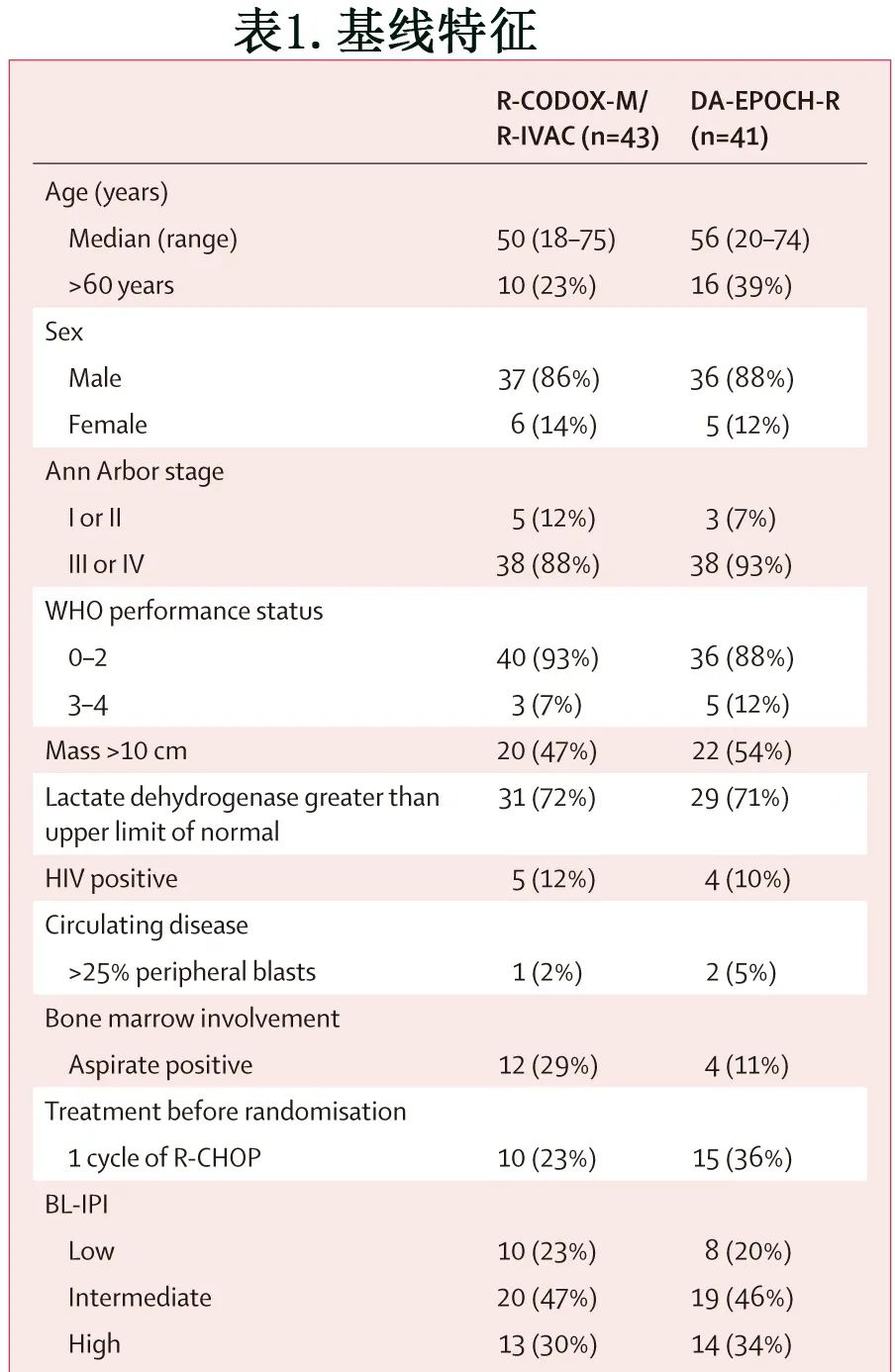
基线特征见表1。84例患者中男性73例(87%),中位年龄52岁,76例(90%)患者为III期或IV期,9例(11%)为HIV阳性Burkitt淋巴瘤。根据BL-IPI分级,84例患者中低危18例(21%)、中危39例(46%)、高危27例(32%)。方案修改后,R-CODOX-M/R-IVAC组10例患者和DA-EPOCH-R组15例患者在随机分组前接受了1个周期的R-CHOP治疗(12例患者在初始R-CHOP治疗后完成了6个周期的DA-EPOCH-R治疗)。
R-CODOX-M/R-IVAC组33例患者和DA-EPOCH-R组37例患者完成治疗。R-CODOX-M/R-IVAC组1例患者在方案治疗开始前拒绝治疗,9例患者因疾病进展(n=4)、过度毒性(n=4)和脓毒症(n=1)停止治疗,治疗阶段有2例死亡(1例进展和1例脓毒症),因过度毒性作用退出研究方案的患者年龄分别为47、59、68和72岁。DA-EPOCH-R组4例患者因疾病进展(n=3)或COVID-19 (n=1;治疗阶段)停止治疗。
疗效
中位随访28.5个月。所有完成治疗的患者(图1)均接受了至少12个月的随访。R-CODOXM/ R-IVAC组和DA-EPOCH-R组的1年PFS率分别为76%和73% (图2A),2年PFS率为76%和70%,主要结局的HR估计值(未校正)为1.47 (P=0.34)。校正白血病负荷和HIV阳性后,PFS的HR值为1.42 (p=0.40)。R-CODOX-M/R-IVAC组发生了10起事件(8起Burkitt淋巴瘤进展或复发,2起死亡),DA-EPOCH-R组发生了15起事件(12起淋巴瘤进展或复发,3起死亡)。24个月后出现的3例事件与Burkitt淋巴瘤进展无关(1例为异基因干细胞移植并发症,2例为继发性恶性肿瘤)。两组均未见中枢神经系统复发。
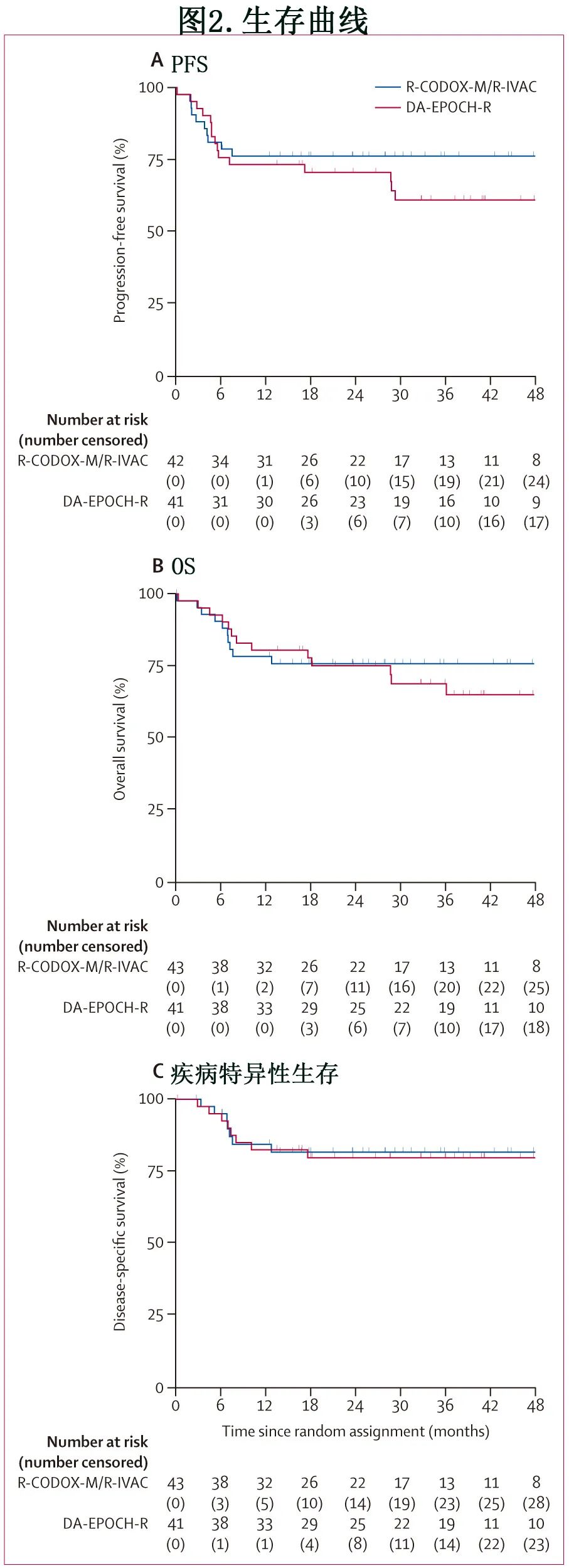
R-CODOX-M/R-IVAC组和DA-EPOCH-R组的1年OS率分别为78%和80% (图2B),2年OS率分别为76%和75% (HR=1.21;p=0.65)。R-CODOX-M/R-IVAC组10例患者死亡(7例Burkitt淋巴瘤,2例感染,1例治疗并发症),DAEPOCHR组死亡13例(8例Burkitt淋巴瘤,2例感染,2例继发性恶性肿瘤[食管癌和尿路上皮癌],1例异基因干细胞移植并发症)。DA-EPOCH-R组24个月后的2例死亡与Burkitt淋巴瘤进展无关(1例为继发性恶性肿瘤,1例为异基因干细胞移植并发症),因此R-CODOX-M/R-IVAC组和DA-EPOCH-R组的1年疾病特异性生存率分别为84%和83%,2年疾病特异性生存率分别为82%和80% (HR=1.10;p=0.86,图2C)。1年无事件生存率,R-CODOX-M/R-IVAC组为62%,DA-EPOCH-R组为66% (HR=0.84;p=0.64),2年无事件生存率分别为62%和63%。
安全性
不良事件总结于表2。在R-CODOX-M/R-IVAC组34例患者中观察到129起3-5级不良事件,而DA-EPOCH-R组30例患者中观察到83起不良事件。此外R-CODOXM/ R-IVAC组患者似乎比DA-EPOCH-R组患者发生更多的感染性不良事件(43例患者中有24例[56%]发生了至少1起3-5级感染性不良事件,而DA-EPOCH-R组41例患者中有14例[34%];p=0.05)。R-CODOX-M/R-IVAC组12例患者(28%)发生了至少1起3-5级血液学不良事件,而DA-EPOCH-R组为5例患者(12%);此外分别有16例患者(37%)和11例(27%)发生至少1起3-5级胃肠道不良事件。
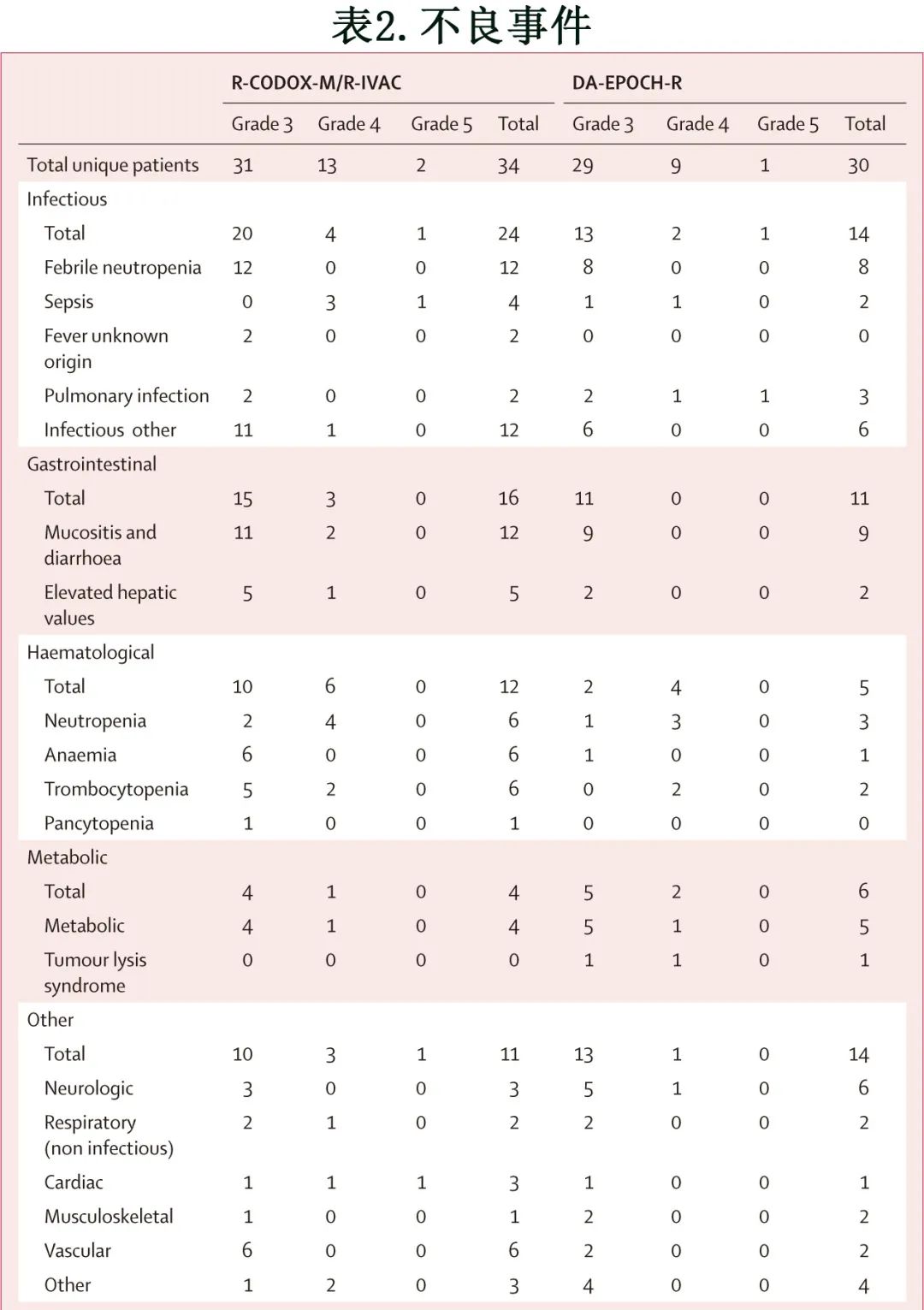
在>60岁的患者中,R-CODOX-M/R-IVAC组10例患者中有9例(90%)发生至少1起3-5级不良事件,而DA-EPOCH-R组16例患者中有12例(75%)发生了至少1起3-5级不良事件。大多数严重不良事件为感染性(包括发热性中性粒细胞减少),并且大多数发生在R-CODOX-M/ R-IVAC组(n=22,DA-EPOCH-R组n=13)。
R-CODOX-M/R-IVAC组中位红细胞输注5次,而DA-EPOCH-R组为1次(p<0.0001;表3),血小板输注分别为2次和0次(p<0.0001)。此外生长因此给药天数分别为51天和27天(p<0.0001)。
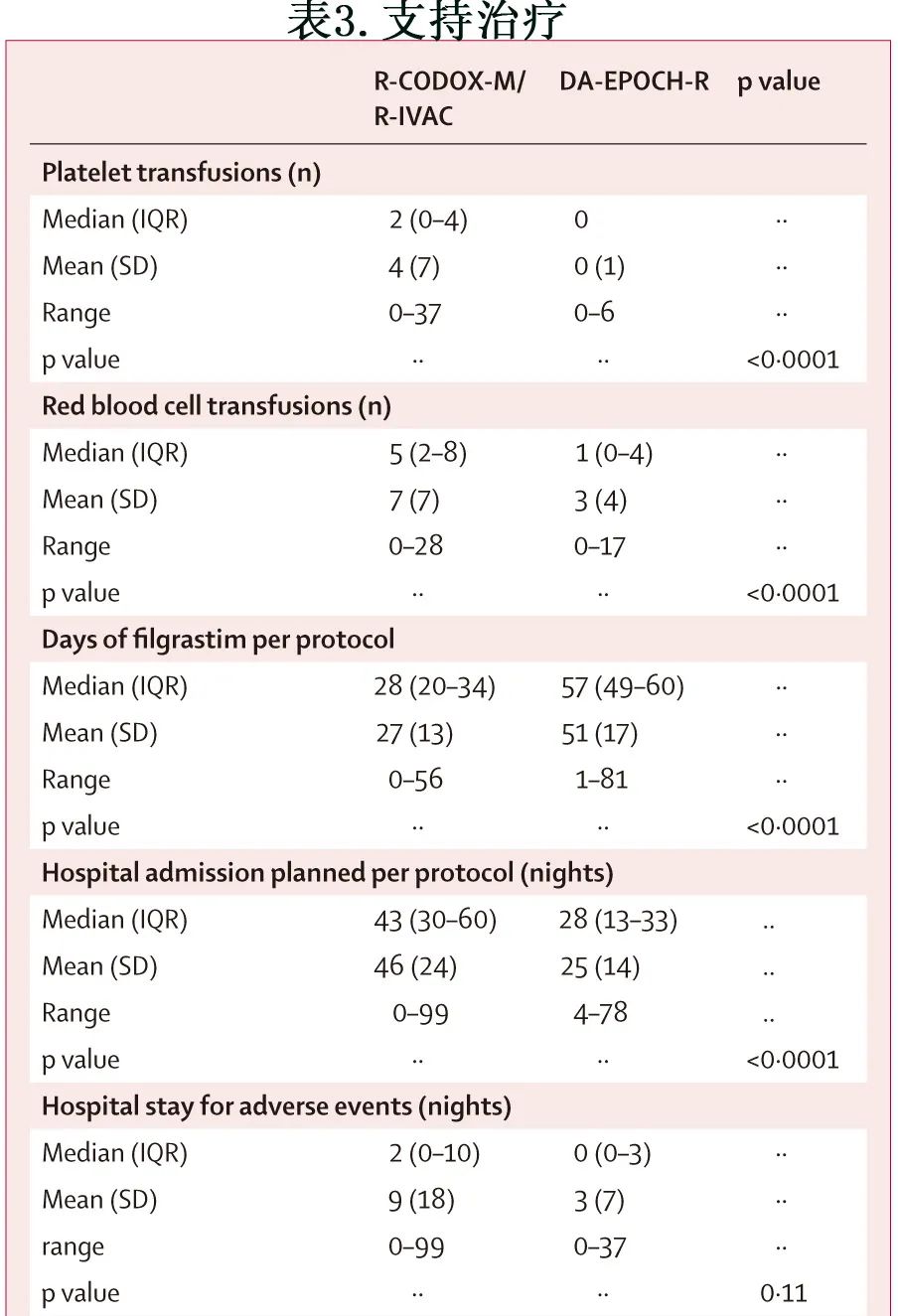
R-CODOX-M/R-IVAC组患者住院的中位时间为43晚,而DA-EPOCH-R组为28晚(p<0.0001);两组因不良事件住院的情况相似(中位住院时间为2晚和0晚)。
总结
该3期研究中84例患者纳入改良意向治疗分析,其中73例(87%)为男性,76例(90%)为III期或IV期疾病,9例(11%)为HIV阳性Burkitt淋巴瘤,中位年龄52岁。中位随访28.5个月, R-CODOX-M/R-IVAC组2年PFS率为76%, DA-EPOCH-R组为70 (风险比=1.42;p=0.40)。R-CODOX-M/R-IVAC组有2例死亡(1例感染[与治疗相关],1例死于疾病进展[与治疗无关]),DA-EPOCH-R组有1例死亡(COVID-19感染[与治疗相关])。R-CODOX-M/R-IVAC组4例患者因毒性作用退出试验方案,而DA-EPOCH-R组中无患者退出试验方案。R-CODOX-M/R-IVAC组发生了较多的感染性不良事件(43例患者中有24例[56%]发生了至少1起3-5级感染,而DA-EPOCH-R组41例患者中有14例[34%])。
该研究是在高危Burkitt淋巴瘤患者中比较两种不同免疫化疗方案(高强度R-CODOX-M/R-IVAC vs低强度DA-EPOCH-R)的第一个多中心、随机研究,显示与R-CODOX-M/R-IVAC相比,DA-EPOCH-R治疗并未获得更好的完全代谢缓解和生存结局,但毒性作用较低,且对支持性治疗的需求较少。总的来说,对于无CNS受累的高危Burkitt淋巴瘤患者,DA-EPOCH-R是一种有效、毒性较小且费用较低的治疗选择。
专家点评
Kenneth J C Lim和Robin Filshie教授认为,关于上述研究必须强调的一个问题在于,其最初设计的统计学效力足以证明DA-EPOCH-R优于R-CODOX-M/R-IVAC,且并非设计为非劣效性研究。再加上患者入组缓慢和未能达到预期的招募目标,无效性分析显示,DA-EPOCH-R显示优效性的概率(如果有优效性的话)仅为20%。因此,尽管两种治疗方案的生存结局无差异,但研究统计学效力和设计不足以完全得出这两种治疗方案同样有效的结论。此外作者肯定希望探讨高危BL-IPI患者或老年患者在不同治疗方案之间的结局是否不同,因为有人可能认为,DA-EPOCH-R因毒性较低可选择性地用于老年患者,也可以用于失败风险可能较低的非高危患者。而上述研究中老年患者和高危BL-IPI患者数量较少,这意味着两个问题都无法得到充分解决。这些问题可能阻止部分临床医师更广泛地使用R-DAEPOCH。
如果仅看上述研究,6个周期的DA-EPOCH-R可能是2个周期R-CODOX-M/R-IVAC的可行、毒性较低的替代方案,并且没有证据表明其CNS复发率较高,部分临床医师可能会选择在老年患者或预测治疗相关发病率或死亡率较高的患者中选择性地采用DA-EPOCH-R。但该研究的结果不应应用于CNS或软脑膜受累的患者,此时含有较大剂量CNS穿透剂的更传统的强化治疗方案仍是首选。虽然两种方案的缓解率都令人鼓舞,但仍有改进的空间,未来整合其他药物(即双特异性抗体)的方法可能倾向于毒性较低的化疗骨架方案,如DA-EPOCH-R,以提高可行性。
参考文献
Martine E D Chamuleau,et al. R-CODOX-M/R-IVAC versus DA-EPOCH-R in patients with newly diagnosed Burkitt lymphoma (HOVON/SAKK): final results of a multicentre, phase 3, open-label, randomised trial.Lancet Haematol . 2023 Oct 31:S2352-3026(23)00279-X. doi: 10.1016/S2352-3026(23)00279-X.
Lim KJC,FilshieR.Is dose-adjusted EPOCH-R the new standard for high-risk Burkitt lymphoma?Lancet Haematol . 2023 Oct 31:S2352-3026(23)00311-3. doi: 10.1016/S2352-3026(23)00311-3.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#Burkitt淋巴瘤# #侵袭性B细胞肿瘤#
61