Molecular Cancer:基于工程化外泌体的原位树突状细胞肿瘤疫苗,用于乳腺癌治疗
2022-02-15 王聪 “生物世界”公众号
作为最有效的抗原呈递细胞(APC),树突状细胞(DC)在肿瘤微环境中是启动和调节先天性和适应性免疫的核心,具有在肿瘤微环境中呈递肿瘤相关抗原(TAA)的能力。
作为最有效的抗原呈递细胞(APC),树突状细胞(DC)在肿瘤微环境中是启动和调节先天性和适应性免疫的核心,具有在肿瘤微环境中呈递肿瘤相关抗原(TAA)的能力。因此,已有多种靶向DC的实验性疫苗并在临床试验中得以改善癌症免疫治疗。
免疫原性细胞死亡(ICD)可增强肿瘤抗原暴露,促进免疫刺激肿瘤细胞内容物的释放,并有利于DC吸收垂死的肿瘤细胞。因此,在肿瘤细胞中诱导ICD将是维持DC充分暴露于肿瘤抗原并绕过鉴定最佳免疫显性抗原的需要的有效方法。然而,DC通常在肿瘤微环境(TME)中表现出较差的成熟度,在呈递肿瘤抗原方面效果较差。
在体内将抗原和佐剂靶向递送至DC是开发DC疫苗的重要方法。全身DC的非特异性激活和最佳免疫优势肿瘤抗原的制备是目前面临的主要挑战。
近年来,外泌体(Exosome)作为一类“天然纳米颗粒”可用于药物输送载体,开始受到广泛关注,因为它们具有低细胞毒性、最大化药物生物利用度,以及出色的靶向归巢特异性等。也有越来越多的临床试验开始探索外泌体的治疗效果。因此,肿瘤来源的外泌体可用作无细胞治疗载体,以浸润肿瘤微环境(TME)进行树突状细胞的激活。
近日,武汉大学中南医院汪付兵、袁纯辉等人在 Molecular Cancer 发表了题为:Engineered exosomes as an in situ DC-primed vaccine to boost antitumor immunity in breast cancer 的研究论文。
研究团队构建了TLR3激动剂和ICD诱导剂组合的工程化外泌体——HELA-Exos,能够原位激活树突状细胞,在乳腺癌细胞中特异性诱导免疫源性细胞死亡(ICD)。在免疫原性差的三阴性乳腺癌(TNBC)的小鼠异种移植模型和人类患者来源的肿瘤类器官中,均产生有效的肿瘤抑制作用。

α-乳清蛋白(α-LA)是一种在大多数人类乳腺癌中表达的乳腺特异性免疫优势蛋白,它作为一种特异性肿瘤归巢蛋白在外泌体表面进一步富集,以增强靶向能力和免疫原性。
在这项研究中,研究团队开发并优化了一种载有Hiltonol(TLR3激动剂,激活树突状细胞)和人中性粒细胞弹性蛋白酶(ELANE,ICD诱导剂)的靶特异性外泌体方法,以构建用于乳腺癌治疗的原位树突状细胞疫苗。
在三阴性乳腺癌异种移植小鼠模型和患者肿瘤细胞来源的三阴性乳腺癌类器官中,这种Hiltonol-ELANE-α-LA工程外泌体(HELA-Exos)在全身给药后,具有在癌细胞中积累的强大能力,并产生更好的治疗效果。
因此,这种基于无细胞外泌体的TLR3激动剂与ICD诱导剂的组合,为设计用于乳腺癌治疗的的树突状细胞疫苗提供了强大而新颖的开发平台。
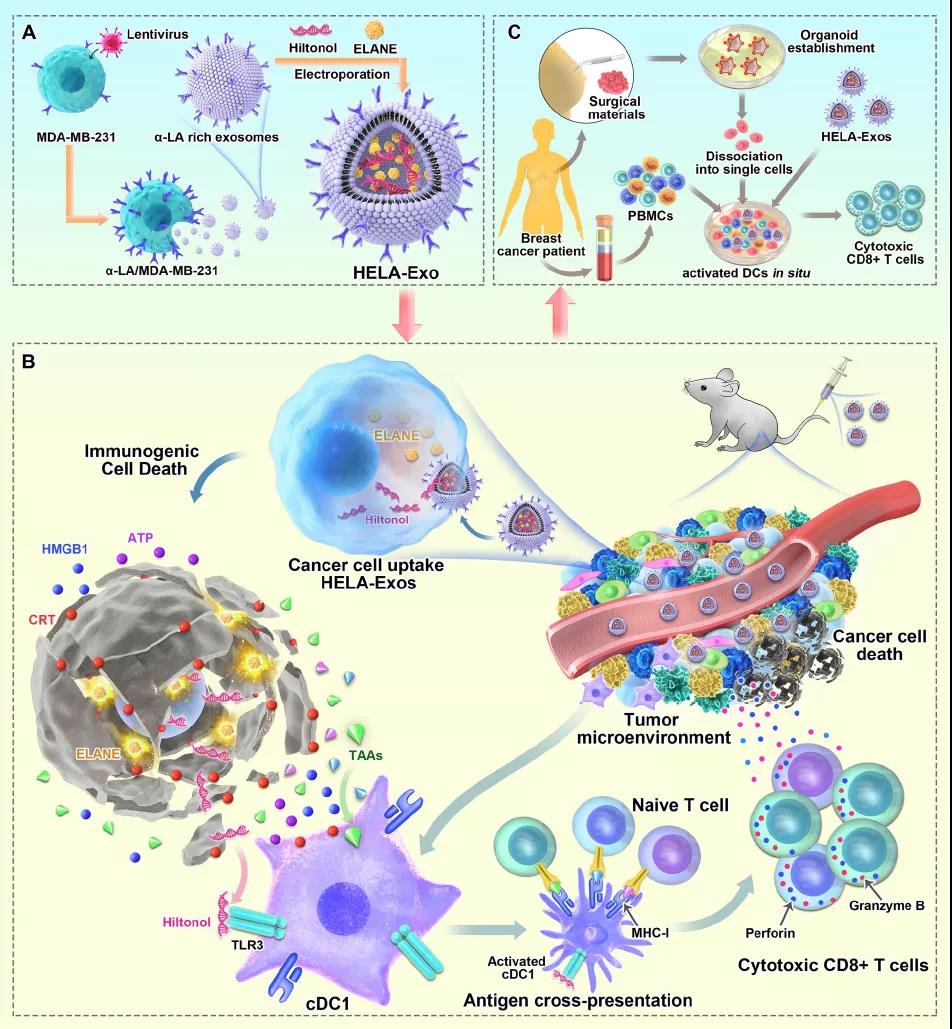
总的来说,该研究开发的HELA-Exos通过促进原位1型常规树突状细胞(cDC1)活化,从而改善随后的肿瘤反应性CD8+T细胞反应,在三阴性乳腺癌异种移植小鼠模型和人类三阴性乳腺癌类器官中表现出强大的抗肿瘤活性。这一策略有望用于产生原位树突状细胞产生的肿瘤疫苗,并且可以扩展到各种类型的癌症。
原始出处:
Huang, L., Rong, Y., Tang, X. et al. Engineered exosomes as an in situ DC-primed vaccine to boost antitumor immunity in breast cancer. Mol Cancer 21, 45 (2022). https://doi.org/10.1186/s12943-022-01515-x.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言