胰腺癌:脂肪和较差预后相关
2016-08-17 佚名 生命奥秘
肥胖问题日益严重,对卫生系统的影响远大于原来的预期,因为研究者们发现,肥胖是肿瘤发生、发展的一大风险因素。肥胖个体胰腺导管腺癌——癌症相关死亡的第四大原因——的发病率明显上升。癌症的一个标志是炎性微环境,但肥胖个体中周围结缔组织(基质)的改变如何影响癌症的发生、发展并不明确。Incio等人发表在《癌症发现》(Cancer Discovery)杂志上的论文研究了在小鼠和人体中,肿瘤周围的脂肪
肥胖问题日益严重,对卫生系统的影响远大于原来的预期,因为研究者们发现,肥胖是肿瘤发生、发展的一大风险因素。肥胖个体胰腺导管腺癌——癌症相关死亡的第四大原因——的发病率明显上升。癌症的一个标志是炎性微环境,但肥胖个体中周围结缔组织(基质)的改变如何影响癌症的发生、发展并不明确。Incio等人发表在《癌症发现》(Cancer Discovery)杂志上的论文研究了在小鼠和人体中,肿瘤周围的脂肪细胞促进肿瘤的发生和发展的机制。
胰腺肿瘤形成涉及到明显的组织结构畸变。这种结构畸变是由于包含消化酶的腺泡细胞被破坏,免疫细胞浸润,强烈的纤维化反应(即纤维化,肿瘤周围形成过量的结缔组织或胶原蛋白),以及高水平的胞外基质材料沉积。肥胖个体的癌病灶通常含有更多的脂肪细胞。然而,胰腺癌在这些脂肪细胞的功能仍不清楚。但Incio等人的研究解开了这个谜团。
Incio等人证明,在小鼠中,脂肪细胞、免疫细胞和胰腺星状细胞通过IL-1β和AT1血管紧张素受体驱动嗜中性粒细胞聚集到肿瘤周围。这增加了胰腺癌微环境中的炎症和纤维化反应,从而导致化疗效果差和预后不良。
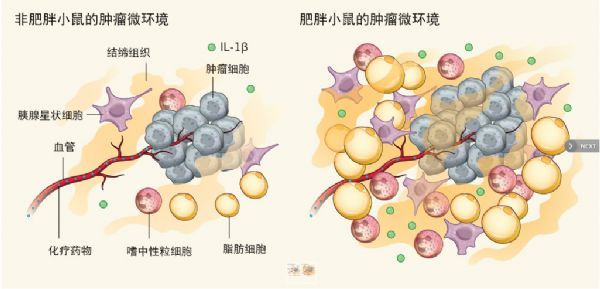
在肥胖小鼠中,肿瘤微环境中的脂肪细胞数目增加,体积变大,部分原因是肿瘤侵入邻近的白色脂肪组织。研究人员观察到,脂肪细胞富集或靠近脂肪组织的肿瘤领域纤维化反应更明显。这些结果表明,纤维化是肥胖胰腺癌小鼠脂肪组织的标志,并且纤维化反应的一个组成部分——细胞外基质胶原蛋白聚集在脂肪细胞附近也是肥胖个体的突出特点。Incio等人还发现,肿瘤微环境的脂肪细胞浸润与患者预后较差和治疗结果不佳相关。
Incio等人推测,胰腺癌患者中,肥胖相关的脂肪积累会增加纤维化,促进肿瘤发展,并阻碍化疗剂的递送和功效。当他们检查小鼠肿瘤特定区域的血液灌注时,他们发现,肥胖小鼠血液灌注明显降低。为了确定血管灌注减少是否会导致化疗剂的低效递送,研究者们测定了小鼠对化疗药物5-氟尿嘧啶的摄取。与非肥胖对照小鼠相比,肥胖小鼠肿瘤对药物的摄取显着降低,从而降低了化疗的疗效(图1)。
胰腺癌:脂肪和较差预后相关
图1 脂肪细胞重塑肿瘤微环境。肿瘤的血供由血管支持,化疗药物随着血管到达肿瘤。Incio等人报告说,肥胖的情况下,肿瘤血管灌注差,限制了肿瘤对药物的摄取,导致化疗效果差。在肥胖小鼠中,胰腺星状细胞、免疫细胞,如嗜中性粒细胞、IL-1β信号传导分子,以及脂肪细胞都有所增加。肥胖小鼠中,密度较大的细胞微环境会对肿瘤组织产生额外的机械应力,并限制血管灌注。这种机械应力的产生是因为脂肪细胞、嗜中性粒细胞、胰腺星状细胞和组织微环境的其它组件发生相互作用。这些相互作用增加了嗜中性粒细胞等炎性细胞的数量,并在肿瘤附近产生过量纤维结缔组织。
慢性纤维化被认为能增强肿瘤生长,降低药物递送效率。然而,在以前的研究中,无论使用抑制剂或是基因工程来抑制慢性纤维化,都会增加免疫抑制、加速肿瘤生长及降低存活,这意味着,肿瘤基质可能限制肿瘤生长。
与此相反,Incio等人显示,阻断主要的促纤维化途径AT1,能够抑制肿瘤进展。他们认为,中性粒细胞迁移至肿瘤以及IL-1β合成是肿瘤生长的主要驱动因子,尽管血压降低导致的灌注减少也起到了一定作用。当研究者们清除掉中性粒细胞或使用抗体阻断IL-1β时,免疫抑制的微环境得以重塑,胰腺癌生长减慢。靶向小鼠AT1受体时,其下游通路——诸如上皮到间充质细胞的转化或脂肪细胞分化——也可能会受到影响。有可能正是这些过程减慢了肿瘤的生长。
尽管研究者们把肿瘤大小和纤维化联系起来,但纤维化反应或肿瘤生长谁先谁后难以判断。因为肿瘤生长减慢,最终会降低免疫细胞浸润,从而降低纤维化。无论是哪种方式,Incio等人的研究结果都提示了,需要重新评估纤维化对肿瘤发生、发展的作用,尤其是在肥胖情况下。
学界越来越认识到,机械应力引起的细胞改变在诸多疾病中都起到了重要作用。稳态中细胞受到的内部和外部的力之间的平衡能调节细胞凋亡、增殖、粘附和迁移。应力失衡可能导致肿瘤。另外,肿瘤微环境中的实体组织所施加的压力可以压缩血管,引起肿瘤灌注不佳。
Incio等人表明,AT1受体阻滞剂氯沙坦可减少细胞的机械应力,并减慢小鼠胰腺癌的生长。目前肥胖情况下,应力变化引起肿瘤微环境变化的转录开关仍需进一步研究。减少胰腺癌细胞受到的机械应力可能是潜在的治疗方法。通过减少基质硬度,使肿瘤细胞外基质正常化,可以比直接清除细胞外基质成分更有效和更安全。
脂肪细胞和干细胞调控之间的关系是另一个关键问题。成熟白色脂肪细胞——即控制能量代谢的脂肪储存——会以分泌信号蛋白的方式对营养条件和激素环境产生响应。研究指出,白色脂肪能调节组织再生和干细胞,这意味着脂肪细胞在癌症发展的多个方面起到重要作用。间充质干细胞和间质干细胞大大促进脂肪细胞的生成。机械应力也是一些干细胞群增长的触发条件。
确定胰腺中脂肪组织的来源、命运和表型(细胞是否形成白色或棕色脂肪,以及它们分泌的物质)非常有意义。其它待研究的内容包括:脂肪细胞募集、甚至促进免疫细胞分化的信号通路;脂肪细胞侵袭在肿瘤形成中的作用以及能量代谢异常在肥胖中的作用。
Incio等人的工作为脂肪细胞与促炎症、促纤维化的肿瘤微环境的频繁互动,加快的疾病进程和疗效不佳做出了合理解释。能否在不影响机体功能的情况下,靶向全身肿瘤相关的中性粒细胞、胰腺星状细胞和脂肪细胞?这是把Incio等人的发现转化成临床手段的重大挑战。针对IL-1β或中性粒细胞是否能提高预后还有待考证。不过最好的方法是加强运动,平衡饮食。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










学习了,好
66
这篇资讯带给我们新知识,启发新思维,不论是科研还是临床工作都有很大的帮助。。。
80
学习啦,谢谢
74
有意思,学习了!
82
需要临床样本加以验证和说服
80
值得学习
0
好好学习一下
47
学习了,赞一个!
43
学习了,赞一个!
48
学习了,赞一个!
40