更火爆CAR-T临床国内上马33个,会重蹈替尼覆辙吗?
2016-04-14 储旻华 干细胞者说
文 | 储旻华 在中国,CAR-T临床试验项目是时下非常热门的新药研究领域,对于行业人士早已不是新鲜词汇。众多的癌症患者和对新治疗手段的渴望,使得这项新技术成为众多医院和公司争相追逐的对象。根据EP Vantage最新统计的数据,Clinicaltrials.gov登记的正在中国开展研究的CAR-T临床试验至少有33个(见下图)。 图:在中国开展的CAR-T临床试验 值
文 | 储旻华
在中国,CAR-T临床试验项目是时下非常热门的新药研究领域,对于行业人士早已不是新鲜词汇。众多的癌症患者和对新治疗手段的渴望,使得这项新技术成为众多医院和公司争相追逐的对象。根据EP Vantage最新统计的数据,Clinicaltrials.gov登记的正在中国开展研究的CAR-T临床试验至少有33个(见下图)。
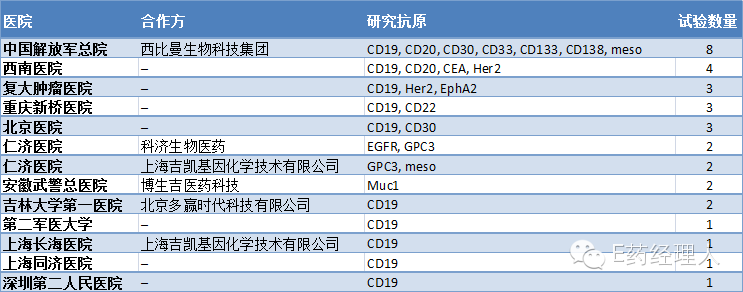
图:在中国开展的CAR-T临床试验
值得关注的是,这些临床试验的合作方都是有故事的参赛者,而且很有可能在接下来成为各种销售授权、技术转让、PRE-IPO等等事件的主角们;此外,靶点也非常重要。
可以看到,这些项目中不仅包括常见的靶点——用于血液癌症CD19,还包括用于实体瘤的靶点以及CAR新结构和富集细胞群的研究。例如,重庆新桥医院靶向于CD22的研究,该疗法类似于Juno的JCAR018。
那么,国内CAR-T热是什么原因造成的?不妨冷思考一下,国内CAR-T研发会重蹈“替尼大爆炸”的覆辙吗?
1参赛者陆续登场
2015年初,西比曼生物科技集团(纳斯达克交易代码:CBMG)与解放军总医院韩卫东教授达成战略性合作。两家机构正在合作开展多项用于血液肿瘤和实体肿瘤的CAR-T研究,靶向于多个抗原,包括CD19、CD20、CD30、EGFR、CD33和CD138。
2015年3月25日,西比曼对外公布了两项CAR-T疗法I期临床试验结果,受到国际关注。其中,CART-CD20治疗7例化疗无效的晚期弥漫性大B淋巴细胞瘤(DLBCL)的I期研究(NCT01735604)结果显示,有效率高达75%。另一项CART-CD19治疗9例成年人、化疗无效、复发的急性B系淋巴细胞性白血病的I期研究(NCT01864889)总有效率为67.7%。
但是,一个月不到,4月7日,著名财经网站Seeking Alpha上一篇报道称,西比曼公司涉嫌诈骗指控,以及CAR-T试验患者死亡等问题导致公司在纳斯达克上市的股票价值下跌一半。
国内另一家重要的CAR-T公司是上海科济生物医药公司(CARsgen Therapeutics)。2015年9月,科济与上海市肿瘤研究所就CAR-T等肿瘤免疫治疗签署了为期5年的战略合作协议。该公司称,目前有7个在研的CAR-T项目,其中2项正在开展临床研究。
早在2015年3月,科济就与上海仁济医院合作开展了GPC3-CAR-T用于难治、复发的肝细胞癌的I期临床试验(NCT02395250)。9月公布的数据显示,接受治疗的6名患者中2名体内的肝癌标志物甲胎蛋白(AFP)下降了90%以上,其中1名患者AFP指标恢复正常。
科济公司的另一项CAR-T研究也是在上海仁济医院进行,是靶向于EGFR,用于胶质母细胞瘤(NCT02331693)。
2016年4月8日,Juno Therapeutics和药明康德在上海宣布成立合资公司药明巨诺,共同开展CAR-T和TCR疗法的研发和生产。虽然Juno和药明康德还没有公布任何临床试验计划,但这两个重量级玩家的携手进入必将撼动国内当前的CAR-T市场。
2Juno是谁?从上海到西雅图Juno是美国著名的T细胞疗法公司,总部位于西雅图,其与药明康德合资成立的这家上海药明巨诺生物科技有限公司,将使用嵌合抗原受体T细胞(CAR-T)和T细胞受体(TCR)技术,开发用于血液肿瘤和实体肿瘤的细胞免疫疗法。

根据协议,药明康德和Juno分别持有药明巨诺股权的50%。Juno的在研产品达到开发里程碑后,药明巨诺有权选择产品在中国进行开发和销售,Juno因此获取相应的预付款或股权、里程金和产品上市后的销售提成。
药明巨诺的董事长为药明康德的董事长李革博士,CEO为此前曾担任凯鹏华盈合伙人和安进中国总经理的李怡平。
药明巨诺的成立,不仅意味着国内又一家专注于CAR-T公司的出现,而且还可以看到,作为一家美国公司,Juno也试图进入中国市场。
3为什么中国有如此多CAR-T
虽然CAR-T疗法非常昂贵,但并不影响这一疗法成为各家医院和公司争相启动的项目。原因只有一个——监管相对较松。与药物临床试验需要花好几个月甚至好几年等待CFDA的批准才能开展不同,CAR-T疗法作为一种新型治疗技术,其临床试验的管理方是卫计委。一般来说,已经取得临床试验机构资质的三级甲等医院就能开展。所以,相对与药物研究,CAR-T的临床试验反而相对廉价,且进入门槛低。
事实上,正因为如此,多年来国内各地不少医疗机构无视法规和科学界的警告,为绝望中的患者提供无效的治疗,并收取高额治疗费用。比如,各种五花八门的干细胞治疗。虽然,卫计委在去年出台了新法规,取消了第三类医疗技术临床应用准入审批,并发布了《干细胞临床研究管理办法(试行)》,但并没有专门针对T细胞疗法临床试验的法规对此进行监管。较低的监管门槛必然导致CAR-T研究在国内遍地开花。
另一方面,中国在审批新型生物治疗上又一向敢为人先。2003年,全球首个基因药物赛百诺的今又生(重组人p53腺病毒注射液)获得批准;2005年全球首个溶瘤病毒产品三维生物技术的安柯瑞(H101)获准上市。这让积极开发新型细胞疗法的公司们看到了成功获批投入商业化应用的希望。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










#CAR-#
50
关注值得学习。赞!好文有待探究。
0
CART已经火到不行了
102
疗效
128
虚火要冷静
135
虚火要冷静
154
努力
77
有一点虚火。
84
加油吧
102
希望有好的结果
102