Science:基因组水平CRISPR-Cas9基因敲除文库构建成功,可定向敲除18000余个基因
2013-12-29 MedSci MedSci原创
张峰教授自从今年3月份在Science发表文章应用CRISPR/Cas实现基因编辑以来,在一年内基因编辑技术取得重大突破。接下来一步法实现小鼠多基因突变方法发表在今年5月份Cell上。接着夏天张峰教授又实现消除CRISPR-Cas的脱靶效应,实现完美基因编辑的新方法,发表在Nature Biotech上。马上进一步改进双切口技术改进CRISPR-Cas编辑效率,文章又发表在9月份Cell上,而12
来自麻省理工学院,哈佛医学院,Broad研究院等处的研究人员,青年华人学者张峰助理教授完成了人类细胞全基因组范围内CRISPR-Cas9敲除筛选,这对于CRISPR-Cas9技术的发展具有重要意义。这一研究成果公布在12月13日Science杂志在线版上。
文章的通讯作者是麻省理工学院脑与认知科学助理教授、McGovern 脑研究所和Broad研究所核心成员张锋(Feng
Zhang,音译),今年七月,Feng Zhang荣获了美国生物医学大奖:瓦利基金青年研究家奖(Vallee Foundation Young
Investigator Award),奖金25万美元。其研究组研究方向为设计新的分子工具来操控活体大脑。
张峰助理教授自从今年3月份在Science发表文章应用CRISPR/Cas用于不同物种以来,在一年内基因编辑技术取得重大突破。接下来一步法实现小鼠多基因突变方法发表在今年5月份Cell上。接着夏天张峰教授又实现消除CRISPR-Cas的脱靶效应,实现完美基因编辑的新方法,发表在Nature Biotech上。马上进一步改进双切口技术改进CRISPR-Cas编辑效率,文章又发表在9月份Cell上,而12月份Science又发表他的文章,在基因组水平对人类细胞进行基因敲除。通过慢病毒载体传递的基因组范围内 CRISPR-Cas9敲除文库建立,能靶向18080个基因进行敲除。此项技术立即用于药物的靶点筛选,以及新药筛选中,取得惊喜的突破。
CRISPRs-Cas9技术成为了最近的新宠儿,这种基因组编辑技术更易于操作,也具有更强的扩展性。此前Zhang研究组曾利用细菌RNA,引
导Cas9核酸酶在小鼠和人类基因组的特定基因位点上进行切割,完成了精确的目标链断裂。他表示,“CRISPR系统即使在从细菌细胞中取出酶和RNA,
然后再插入到哺乳动物细胞中之后,依然能如此有效的工作,这令人惊讶。”
在此基础上,研究人员发现靶向18,080个基因(64,751个独特靶向序列)的全基因组范围CRISPR - Cas9敲除(GeCKO)文库慢病毒传递,能进行在人类细胞中的正向和负向选择性筛选。
研究人员先利用GeCKO文库鉴定了对癌症和多能干细胞细胞活力必不可少的基因,其次他们还在一个黑素瘤模型中,筛选出了涉及药物维罗非尼(Vemurafenib)耐药性的基因。
从中研究人员筛选出了多个有效的基因,比如之前曾发现的NF1和MED12,以及未曾发现过的NF2,CUL3,TADA2B和TADA1 。
作者指出靶向同一基因的独立导向RNAs之间存在高度的一致性和高命中确认率,这对于Cas9基因组范围内筛选具有重要意义。
目前靶向基因组编辑技术已广泛用于基础研究和临床应用。CRISPR-CAS系统中的Cas9核酸酶能通过20nt导向序列靶向特异性基因组位点,允许某些与DNA靶标的错配,从而促进一些意外脱靶突变的形成。
Zhang研究组此前还揭示了一种增加基因组编辑特异性的新方法,即利用RNA导向的CRISPR-Cas9系统形成双切口,在未影响靶向切割效率的前提下,方便小鼠受精卵基因敲除研究原始文献:
Shalem O, Sanjana NE, Hartenian E, Shi X, Scott DA, Mikkelson T, Heckl D, Ebert BL, Root DE, Doench JG, Zhang F.Genome-Scale CRISPR-Cas9 Knockout Screening in Human Cells.Science. 2013 Dec 12.
Ran FA, Hsu PD, Wright J, Agarwala V, Scott DA, Zhang F.Genome engineering using the CRISPR-Cas9 system.Nat Protoc. 2013 Nov;8(11):2281-308.
Ran FA, Hsu PD, Lin CY, Gootenberg JS, Konermann S, Trevino AE, Scott DA, Inoue A, Matoba S, Zhang Y, Zhang F.Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity.Cell. 2013 Sep 12;154(6):1380-9.
Feng Z, Zhang B, Ding W, Liu X, Yang DL, Wei P, Cao F, Zhu S, Zhang F, Mao Y, Zhu JK.Efficient genome editing in plants using a CRISPR/Cas system.Cell Res. 2013 Oct;23(10):1229-32.
Hsu PD, Scott DA, Weinstein JA, Ran FA, Konermann S, Agarwala V, Li Y, Fine EJ, Wu X, Shalem O, Cradick TJ, Marraffini LA, Bao G, Zhang F.DNA targeting specificity of RNA-guided Cas9 nucleases.Nat Biotechnol. 2013 Sep;31(9):827-32.
Wang H, Yang H, Shivalila CS, Dawlaty MM, Cheng AW, Zhang F, Jaenisch R.One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering.Cell. 2013 May 9;153(4):910-8.
Jiang W, Bikard D, Cox D, Zhang F, Marraffini LA.RNA-guided editing of bacterial genomes using CRISPR-Cas systems.Nat Biotechnol. 2013 Mar;31(3):233-9.
Cong L, Ran FA, Cox D, Lin S, Barretto R, Habib N, Hsu PD, Wu X, Jiang W, Marraffini LA, Zhang F.Multiplex genome engineering using CRISPR/Cas systems.Science. 2013 Feb 15;339(6121):819-23.
小知识:CRISPR技术与基因编辑
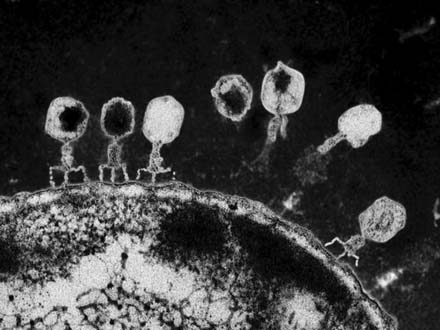
细菌也会生病,这对于乳品业来说是一个潜在的大问题。乳品业通常依靠细菌(诸如嗜热链球菌)生产酸奶和乳酪。嗜热链球菌将牛奶中的乳糖分解为有刺激性的乳酸。但是某些病毒,诸如噬菌体能逐步削弱细菌,进而对在细菌作用下生产的食物的质量或数量造成严重损害。
CRISPR技术
2007 年,来自丹尼斯克公司(一家总部位于丹麦哥本哈根的食品添加剂公司,目前被杜邦公司收购)的科学家找到了一种能增强细菌防御噬菌体能力的方法。这一发现使 得杜邦公司能够为食品生产培育更强壮的菌株。一些基本的原理也被揭示:细菌具备一种有高度适应性的免疫系统,使得它们能击退来自某种噬菌体的多次进攻。
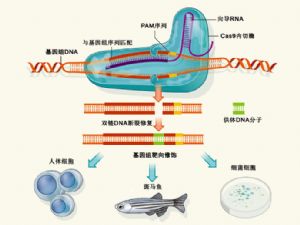
突 然之间,不仅是食品科学家和微生物学家,很多领域都意识到细菌免疫系统的重要性,因为它具备一个非常有价值的特性:以某个特定的基因序列为目标。今年1 月,4个研究团队报告了这一被称为CRISPR的系统。在接下来的8个月中,许多科研团队利用它来删除、添加、激活或抑制人体、老鼠、斑马鱼、细菌、果 蝇、酵母、线虫和农作物细胞中的目标基因,从而证明了这个技术的广泛适用性。
美国哈佛大学的George Church说,生物学家最近开发了一些新方法来精确操纵基因,“但CRISPR的功效和易用性在各方面都更胜一筹”。Church的实验室是首批将该技术应用于人体细胞的实验室之一。
基 于CRISPR,科学家构建人类疾病小鼠模型的速度要比之前快得多,研究单个基因则更为快速,能立刻容易地改变细胞中的多个基因,以便研究它们的相互作 用。但是今年研究CRISPR的热潮可能会减退,因为这种方法的局限性开始显现。但Church和其他CRISPR的先驱者已经成立了公司,希望利用这项 技术治疗遗传性疾病。美国波兹曼市蒙大拿州立大学生物化学家Blake Wiedenheft说:“我不认为有任何领域的任何例子能够说明这项技术发展得过快。”
蹒跚起步
这 种新基因工程工具于1987年被首次报道,一个研究团队在一个细菌基因的一端观察到一个奇怪的重复序列。这一现象当时并未引起太多人的注意。十年后,破译 微生物基因组的生物学家经常发现类似令人费解的模式(一个DNA序列紧跟着几乎完全相同但以相反方向构造的序列)。这一模式出现在超过40%的细菌和 90%的古生菌中。
很多研究人员假定这些奇怪的序列是毫无意义的,但是2005年,三个生物信息学团队报告,间隔区DNA 通常和噬菌体的基因序列相匹配,表明CRISPR在微生物免疫中可能发挥了作用。加州大学(UC)伯克利分校生物化学家Jennifer Doudna说:“这是一个非常重要的线索。”而马里兰州贝塞斯达市美国国家生物技术信息中心的Eugene Koonin和他的同事则提出,细菌和古生菌占据了噬菌体DNA,之后将其作为RNA分子(能阻止外来DNA的匹配)的一个模板保存起来,就像真核细胞利 用一个被称作核糖核酸干扰(RNAi)的系统摧毁RNA一样。
2007年,丹尼斯克团队的Rodolphe Barrangou、Philippe Horvath和其他人证明,他们能通过添加或删除和噬菌体DNA相匹配的间隔区DNA,改变嗜热链球菌对噬菌体攻击的抵抗力。在那 时,Barrangou(目前就职于美国罗利市北卡罗来纳州立大学)并未充分发挥CRISPR的全部潜能。他说:“我们还不清楚这些元素能否像引人注目的 基因编辑技术那样,成为随时可利用的技术。”
Doudna与目前任职于德国亥姆霍兹感染研究中心和汉诺威医学院的 Emmanuelle Charpentier开展了下一个步骤。它们独立地梳理了各种和CRISPR相关的蛋白质所发挥的作用,研究间隔区DNA如何在细菌的免疫防御中发挥作 用。但是这两名专家很快转而研究依赖一种被称为Cas9的蛋白质的CRISPR系统,因为这个CRISPR系统比其他CRISPR系统更简单。
遭 遇噬菌体入侵时,CRISPR会作出反应,此时细菌把间隔区DNA和DNA回文序列转录成一串长的RNA分子。tracrRNA(一个额外的RNA片段) 和Cas9一起作用产生crRNA(源自间隔区的RNAs)。Charpentier的团队于2011年将这一发现报告在《自然》杂志上。该团队提 出,Cas9、tracrRNA和crRNA一起以某种方法攻击和crRNA配对的外来DNA。
席卷全球
速 度并不是CRISPR的唯一优势。Church的团队正在推广TALENs(合成核酸酶)在人体细胞中的使用。在3种类型的人体细胞中,在切割目标DNA 方面,CRISPR系统要比TALENs更高效,且能比TALENs处理更多的基因。为了说明CRISPR系统的简便性,Church的团队合成了成千上 万的向导RNA序列——可锁定90%的人类基因。
几乎和Church的论文同时出现的一篇独立研究论文(由美国马萨诸塞州 博德研究所合成生物学家Feng Zhang和他的同事完成)显示,CRISPR能立刻锁定和切割人体细胞中的两个基因。在和马萨诸塞州怀海德生物医学研究所发育生物学家Rudolf Jaenisch的合作中,Zhang分裂了小鼠胚胎干细胞中的5个基因。
这些工作为培育变异老鼠打下了基础,这是生物医学研究的一个关键工具。一个方法是,将发生突变老鼠的胚胎干细胞植入一个正在生长的胚胎中。他的团队发现,这能简单地将Cas9信使RNA和两个向导RNAs注入老鼠的卵子或受精卵中。
根据Zhang的CRISPR技术,一个新的小鼠模型即将在几周内投入测试。Zhang认为,这种方法并不局限于老鼠。只要你能操纵胚胎并重新植入胚胎,你将可以在更大型的动物(甚至灵长类动物)上开展该研究。
在 Zhang和Church的报告在线发表3周之后,Doudna的团队和一个韩国研究小组报告称,他们成功利用CRISPR切除了人体细胞的DNA。与此 同时,另外一个小组透露,他们利用CRISPR创造出变异的斑马鱼。一系列的研究报告造成了协同效应,为生物界赢得了广泛的关注。北卡罗来纳州达勒姆市杜 克大学生物医学工程师Charles Gersbach说:“如果只是一份报告发表的话,仅会获得一些关注。但是当有6份报告同时发表时,这便意味着它是大势所趋。”
一 年前,当高彩霞看到Doudna和Charpentier的研究报告后,她被他们的理论所折服。高彩霞的团队来自北京市中国科学院遗传与发育生物学研究 所,她们已经利用锌指结构和TALENs技术在大米和小麦上进行研究。通过利用CRISPR,她的团队已经成功地令大米的4种基因失去功能,这意味着该技 术可以用于改良大米这种重要的农作物。至于小麦,她们剔除了一种基因,使小麦获得了白粉病抗性。CRISPR的进展令人兴奋,高彩霞团队的研究报告发表在 8月刊的《自然—生物技术》上,与此同时,还有另外4篇关于CRISPR在植物和老鼠身上的研究成果的报告同期发表。
CRISPR 的使用成本很低:免费的软件使得设计向导RNA(用于针对特定的基因)的成本为零,另外只需花费65美元便可以从名为Addgene的基因资源库中获取基 因,来设计自己的CRISPR系统。自今年开始,Addgene(共有11个科研小组为它提供了可用于CRISPR系统的DNA序列)已经见证了5000 种CRISPR构造的产生。今年7月,Addgene在一周内就收到了(为了设计一种新构造的)100份订单,Addgene的执行董事Joanne Kamens说:“Addgene正在热卖中。”
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








比较新的技术啊,可以
87
比较新的技术啊,可以
141
比较新的技术啊,可以
114
比较新的技术啊,可以
152
比较新的技术啊,可以
156
比较新的技术啊,可以
134
比较新的技术啊,可以
193
比较新的技术啊,可以
106
比较新的技术啊,可以
62
比较新的技术啊,可以
144