从仿制药挑战专利案例观策略
2019-01-06 中睿医药评论 中睿医药评论
美国的林肯总统曾作过关于发现和发明的讲座(Lecture on Discoveries and Inventions),后人将其精神总结为“专利制度给天才之火浇上了利益之油”(The Patent System added fuel of interest to the fire of genius)。此言道出了专利制度在人类技术进步中所起到的促进作用。专利制度也极大地影响、甚至是塑造了现在的
美国的林肯总统曾作过关于发现和发明的讲座(Lecture on Discoveries and Inventions),后人将其精神总结为“专利制度给天才之火浇上了利益之油”(The Patent System added fuel of interest to the fire of genius)。此言道出了专利制度在人类技术进步中所起到的促进作用。专利制度也极大地影响、甚至是塑造了现在的医药市场。专利药(创新药、原研药)通过专利制度获得市场独占权,及其带来的定价权,从而获得高额利润。
过去几年里,在密集出台的政策、充足活跃的资本、众多归国人才的推动下,中国创新药产业蓬勃发展,大家都在讨论创新药、研发创新药、憧憬创新药。曾经争夺激烈的首仿药似已黯淡无光,尤其在2016年3月的化药注册分类改革后,3类化药(首仿)失去了行政监测期。2017年10月和2018年12月,中国药物审评中心(CDE)发布了首批和第二批专利权到期、终止、无效且无仿制申请的药品清单,所选皆为具有明确临床价值的药品,以引导仿制药研发生产,提高公众用药可及性。这意味着国家层面有意推动首仿,而专利挑战则是最快获得首仿资格的捷径。专利挑战在美国经历了数十年的发展。下面我们就通过分析美国的专利挑战制度和案例,并加以总结分析,以期能够给中国的专利挑战制度建设提供一些参考价值,给中国药企进行专利挑战和/或专利保护提供一些借鉴意义。
美国的专利挑战制度简介
美国1984年通过的《药物价格竞争和专利期补偿法》(Hatch-Waxman amendment)简化了仿制药的申报资料,免除了全面的临床试验数据,仅需证明仿制药与专利药(原研药)的治疗等效性(therapeutic equivalence)。此种申请被称为简略上市申请(abbreviated new drug application, ANDA)。
美国FDA公布经过治疗等效性评价批准的药品清单(Approved Drugs with Therapeutic Equivalence Evaluation),称为橙皮书(Orange Book)。H-W法案要求专利药(原研药)向FDA报告专利状况,FDA将其登记在橙皮书,并公示专利和数据独占状态。仿制药在提交ANDA时,必须同时提交参考上市药物(reference listed drug, RLD)的专利状态证明,包括第一段至第四段证明(Paragraph I-IV certification),具体如下。
Paragraph I certification:没有专利;
Paragraph II certification: 有专利,但已过有效期;
Paragraph III certification:有专利,但是本申请不寻求在专利有效期内上市;
Paragraph IV certification:所登记专利为无效专利,或本申请没有侵权。
第I、II段证明的仿制药可直接批准上市。第III证明的仿制药只能获得暂时批准(tentative approval),须在原研专利过期后才能获得正式批准上市。第IV段证明则为专利挑战,由法庭来判定专利是否无效或仿制药是否侵权。
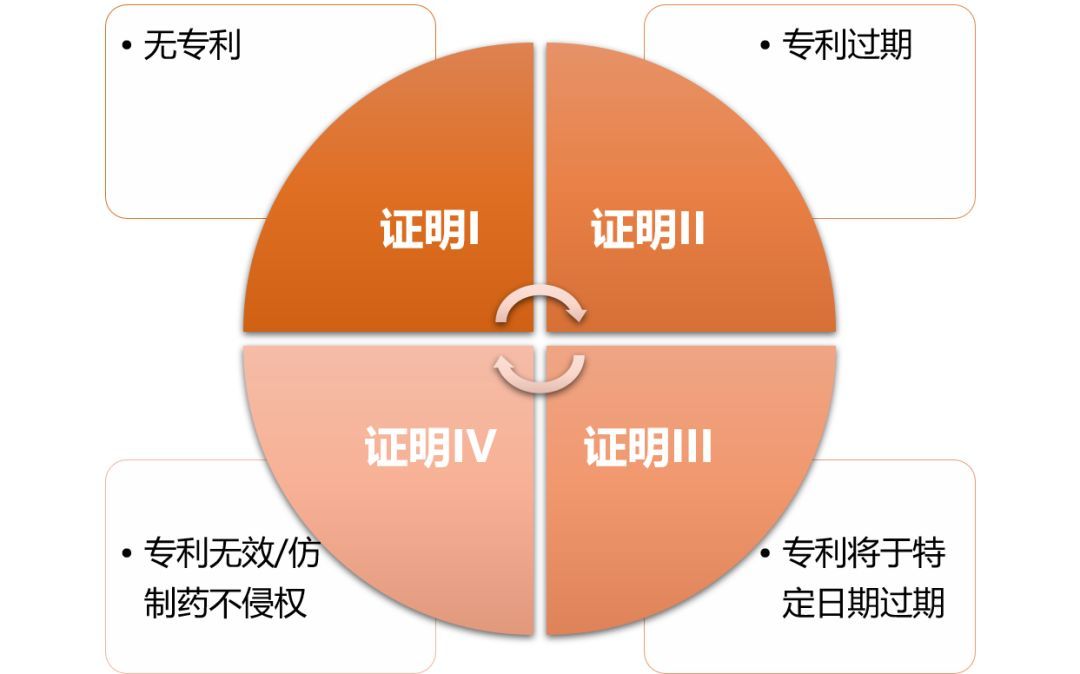
Figure 1.仿制药的专利证明分类
1984年的改革没有把重点放在专利挑战上,实施起来暴露出许多规则上的漏洞,直到1998年,FDA仅批准了3个专利挑战药物。为推动仿制药发展,降低药价,美国在1998、2003和2012年多次次修改专利挑战的规则,使其逐渐成为仿制药与原研药争夺市场的利器。从1998年开始,越来越多的专利药受到专利挑战,且从专利药上市到第一个专利挑战申请(first-to-file, FTF)的时间间隔越来越短。因为诉讼费用较高,高价值专利药物,如年销售额2.5亿美元的药物,自然成了专利挑战的标的。
限于篇幅和主旨,对于提交第IV段声明的详细流程,如起诉、遏制期、上诉、和解、抢先上市等内容就不再赘述了。

Figure 2. 年销售额高于2.5亿美元的专利药遭遇专利挑战的比例和首次时间
专利挑战络绎不绝,愈演愈烈,和其所能带来的利好是密切相关的。
★180天市场独占期。在此期间,竞争对手只有专利药和可能的授权仿制药,竞争格局宽松。定价一般为原研的80-90%,美国的医保体系和药物替代法保证了低价首仿药的销售。
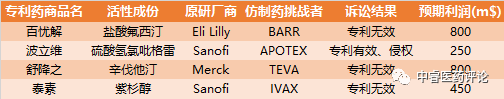
Table 1. 专利药专利挑战预期利润
★市场份额和商誉。专利过期后,首仿药一般可抢到20-80%市场份额,超过后来的仿制药。小企业完全可以通过专利挑战以小博大(案例众多),独占期内的品牌效应为企业带来声誉。
专利挑战案例及分析
美国的橙皮书主要包含3类专利:化合物(活性成份)专利,制剂/配方专利,方法/用途专利。注意原研药企也可以声明一个涵盖活性成份制造方法的专利。这种专利不列在橙皮书中,侵犯此类专利同样会被起诉,只是不具有30个月遏制期等FDA的法规规定的专利效能。因此在尽职调查中应该包含此类专利的早期检索,仿制药企可通过设计替代合成方法来绕开此类专利。对于专利挑战策略最好的指导就是实际案例,接下来我们就来分析专利挑战和防护双方,即仿制药企和原研药企各自的策略。
化合物(活性成份)专利:专利药的强力武器
此类专利可涵盖化学成分自身,也包括化学成分的多晶型(或者伪多晶型和无定型物质)或活性成分的对映异构体。按照ANDA途径申报注册的仿制药必须和参考上市药物具有相同的活性成份。这意味着申报的仿制药通常会侵犯参考上市药物的化合物专利。除非专利权利要求提供了一个非侵权论证(罕见)的开口,仿制药必须使专利无效或使其不可强制执行。
如果缺乏专利权利要求不清楚或不可用的可行的论证,对于化合物专利有效性的中心攻击必须基于缺乏新颖性(预期)或具有显而易见性,但是这正是使化合物专利强有力的原因。对于新颖性,活性成份很罕见被基于现有技术发表的东西预言。仿制药企仍然应该进行全面的现有技术检索,尤其是寻找专利药的疏忽,例如分子在一场科学会议中被透露或在一个专利中作为一小类结构相关化合物被透露。建立药物活性成分专利的显而易见性具有挑战性,美国联邦巡回法院告知药物技术应视为内在不可预知的。联邦巡回法院还特地指出仅现有技术化合物和权利要求化合物结构上的相似性不能确立先导化合物选择。
对于吡格列酮、恩替卡韦的专利挑战是两个表面看起来相似的结构显而易见性案例,但有非常不同的结果。前者是对糖尿病药物吡格列酮(商品名 Actos)活性成份专利的失败挑战。后者无效了乙肝药物恩替卡韦(商品名 Baraclude 博路定)的活性成份专利。
吡格列酮案例
在吡格列酮案例中,对声明专利的权利要求1,2和5处于争执中。权利要求1是对于下面的结构式或一个药学上可接受的相关盐。
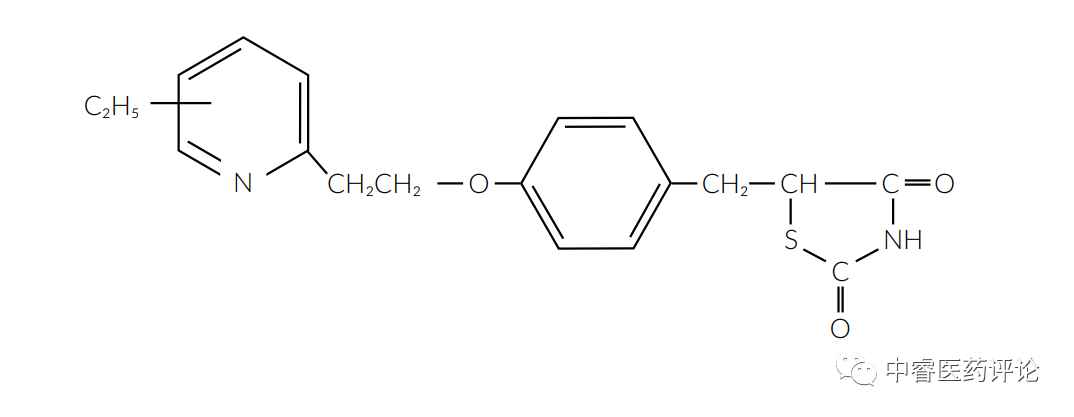
Figure 3. 吡格列酮化合物专利的权利要求1结构
注意左边的C2H5-(乙基)取代基连接在一个不确定的位置上。因此,它可以吡啶环上移动并连到任意可行位置。环行是一种直接且常见的药物开发方法,并且反映在此权利要求中。在权利要求2中,乙基取代基固定在吡啶环的5位。权利要求2的结构式如下所示。

Figure 4. 吡格列酮化合物专利的权利要求2结构
武田(Takeda)的一项较早的专利明确提出相同基础结构的化合物特别有前景,但并非5位乙基,它在6位有一个甲基(CH3-)。换言之,一些辩护者的争论是从6位到5位显而易见(权利要求1所示环移),以及一个1碳取代基(甲基)变为2碳取代基。这种碳链延长的过程也是药物开发的一个常见方法,被称为同系化,每个取代基都是其他的同系物(此处的同系物仅为通过增减碳原子形成的碳链)。
这个案例涉及复杂的被告人立场的适当性及立场的变化,并最终以向原告支付律师费和诉讼费而告终。不成功的关于显而易见性的争论核心为,常见的关于环行和同系化的药物开发原则可以激励和引导一个具有普通技术的人从有前景的6-甲基现有技术产物到5-乙基吡格列酮。接受这个论证-应用一般原则的显而易见性-可能有争议。如果药物开发的一般原则能够照例被应用于现在技术的先导化合物,这潜在可使许多活性成分专利因显而易见性无效。如此案例所示,专利挑战案例中对于活性成份专利的结构的显而易见性的挑战通常失败。
恩替卡韦案例
然而对于恩替卡韦案例而言,从左侧现在技术的先导化合物到右侧‘244专利中的恩替卡韦,被认为是显而易见的。法庭认为这个转变-现在技术的二氢 2‘-CDG先导化合物到亚甲基取代(红色部分)的恩替卡韦-是由一个现有技术的参考(Madhavan)具体激励的。恩替卡韦本身没有在现有技术中透露,但是在结构相似的Madhavan化合物,亚甲基取代被发现赋予一系列抗病毒化合物改进的特性。
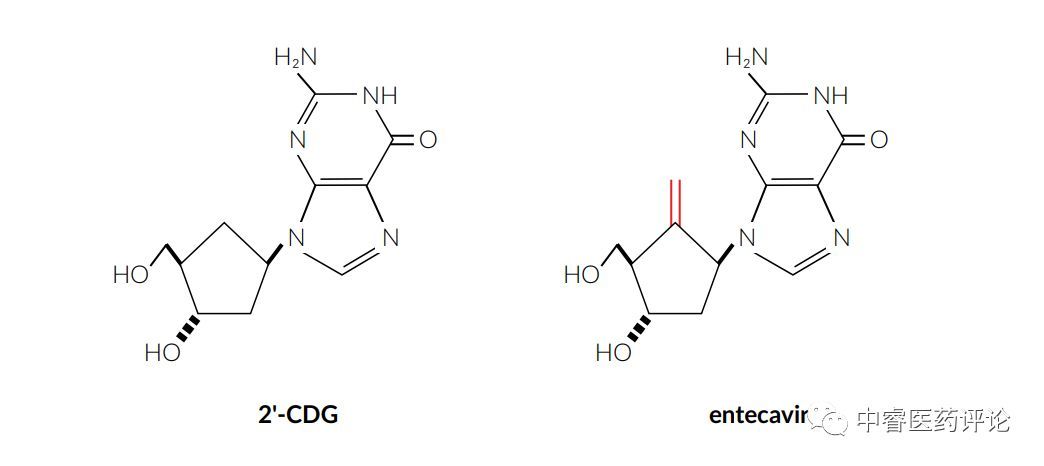
Figure 5. 恩替卡韦(右)及其先导化合物(左)
专利权人自己承认下列事实
(1)研究者将2’-CDG视为一个先导化合物。
(2)Madhavan透露了在其他系列抗病毒化合物亚甲基改变具有的改进的特性。
(3)在5’位置添加亚甲基对于具有普通现有技术水平的人来说是合理的。
这些发现证实了初步的结构显而易见性。显而易见性的初步展示能被非显而易见性的间接标志反驳,如发明的商业成功或发明未预见的结果。然而在恩替卡韦案例中,这些次要考虑因素都弱。
(1)有限的商业成功。
(2)未预见结果(如较低的毒性)的量级相对较小。
在上诉中联邦巡回法院维持了原判,认为:
(1)2’-CDG化合物是先导化合物(即后续开发的自然的选择)。
(2)环外亚甲基是次要改变,习自现有技术的Madhavan参考,在结构相似的多系列化合物中亚甲基化分子显著优于非亚甲基分子。
至于次要考虑因素,受理上诉的法庭发现专利药物的销售次优,并且抗病毒性质的任何改进都是可预料的程度上的差别,而不是未预料到的质的区别。因此,这个活性成分专利因结构的显而易见性被无效,专利挑战成功。
由吡格列酮和恩替卡韦案例得到的结论
对于专利挑战者,需要记住以下要点:
(1)由结构的显而易见性来无效专利虽然并非不可能,但是困难。如果可能,应当避免依靠显而易见性为仅有的专利无效基础。
(2)不要仅仅依靠对于现有技术的先导化合物应用药物开发的一般原则来建立显而易见性。
(3)在制药技术中,只有具体的据现有技术的指导、激励、或建议,指向非常密切相关的化学结构,才能被预期以结构显而易见性来无效活性成分专利。你应该仔细审阅现有技术怎样用于具体指导修饰先导化合物和紧密相关的化合物。
对于专利所有人,核心战略考虑应是最小化定义优良先导化合物。提早指导内部人员不要猜测,不随便地谈论先导化合物的决定。仔细审查现有技术,以确保对先导化合物和紧密相关化合物的修饰的具体透露不会使活性成份专利权利要求易被攻击。
制剂/配方专利:专利药的较弱武器
此类专利指向剂型,并且可以包括如速释或延迟释放剂型。对于配方专利,企业经常可以宣称仿制药是基于绕开专利权利要求(有时是权利要求定义的问题)的设计,来进行无侵权辩护,也可以声明专利无效和/或不能强制履行。
与活性成份专利不同,配方专利或许较易于被发现基于应用一般设计原则的显而易见性。特别是辅料已知具有特殊性质,并且他们的选择按照某种程度上标准化的程序。一个好例子就是下面讨论的唑吡坦案例。
唑吡坦案例
Actavis挑战Purdue Pharm指向低剂量唑吡坦舌下片(商品名 Intermezzo)治疗午夜失眠(middle-of-the-night insomnia, MOTN)的专利权利要求。现有技术指导全剂量口服(吞服)唑吡坦(商品名 Ambien)来治疗整晚的失眠。
仿制药关于专利显而易见的论证要点如下:
(1)将整晚的唑吡坦剂量分一半用于午夜失眠,一半Ambien用于一半夜晚睡眠,只是常识和避免过量的残余效应。
(2)既然午夜醒来者,已经在床上且不情愿地醒来,想立刻回到睡眠-对于速度的需求-舌下剂型是显而易见的,因为它有较快的药物递送,可立即进入循环系统,绕过经肝代谢。
专利持有人反驳的主旨为如果人午夜醒来,一些睡眠缺陷的问题已经解决了。所以,具有普通现有技术的人会假设如要回到睡眠,病人将需要比整晚剂量更高的唑吡坦剂量。然而,较高的剂量因其残余效应是有害的。专利持有人认为在其专利发明之前,治疗午夜失眠的问题似乎解决无望,所以解决方案提供了一个远非显而易见的发明。
经过庭审,法院认为专利因显而易见性而无效,接受了仿制药的常识性显而易见性的论证,并拒绝了专利持有人的相当反直觉的非显而易见性理论。联邦巡回法庭无意见确认。
奥美拉唑基础涂层专利案例
Andrx Pharms挑战Astra Aktibolag,声明的专利指向奥美拉唑(质子泵抑制剂,用于治疗酸相关症状,如酸反流)的固体剂型,具体为该专利指向具有酸性肠溶包衣(为抵抗胃酸)和碱性核心的小球,以保护活性成份,且在肠溶包衣和碱性核心之间有一个隔离层。此隔离层估计用于阻止酸性肠溶包衣和碱性核心的相互作用。肠溶包衣确保小球在胃的严苛环境下能完整通过。
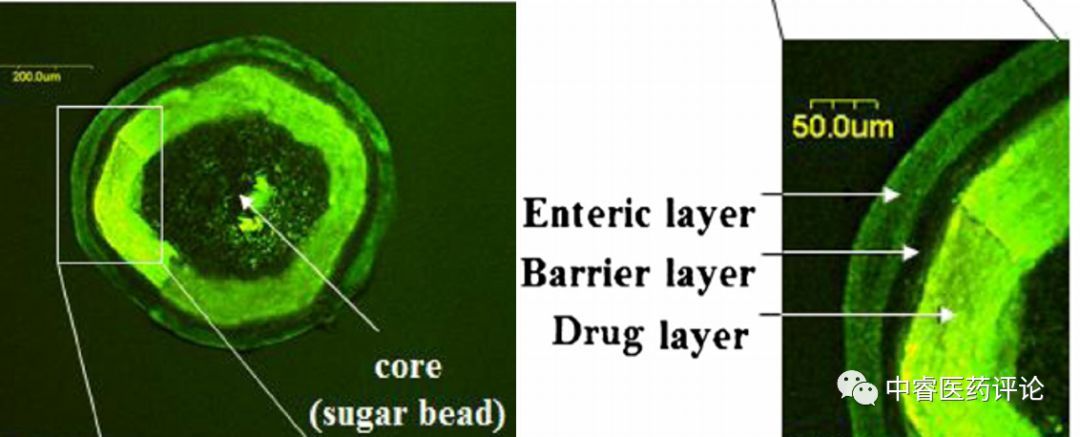
Figure 6.奥美拉唑专利药剂型示意图
为避免专利的小球结构,一些仿制药设计仅有核心(应是非碱性)和肠溶包衣,但无隔离层的小球。但是一种仿制药,KUDCo,设计了避免任何碱反应化合物的微片,因此应该是省去了碱性核心。在庭审中,法院发现所有试图通过省去他们剂型中隔离层的来避免权利权利要求的仿制药都实际上侵权了。法院发现只有KUDCo没有侵犯专利。
表面上这一结果似乎出人意料,但是这些仿制药剂型的底层化学给法院发现侵权提供了基础。即使这些仿制药故意省去隔离层,一个原位酸碱反应产生的盐层自然地形成,作为碱性核心和酸性包衣酸碱相互作用的结果。这个盐层阻止了进一步的反应,而且成为了碱性核心和酸性包衣的隔离层。因此,除了KUDCo之外的所有仿制药都被视为侵犯配方专利并且在专利到期前不可上市。
由唑吡坦和奥美拉唑案例得到的提示
对于专利挑战者,以下几点值得学习。
(1)保持显而易见性论证简单且基于常识。在唑吡坦案例中,仿制药关于显而易见性的理由简单且符合常识:半片用于半晚的睡眠,在舌下提供快速吸收。与之相比,专利持有人的理由看起来反直觉:较少的睡眠需要较多的药。
(2)保有一个有药物制剂经验的专家。配方专利经常易于受到显而易见性挑战,因为通常使用标准的、可靠的和常识性的解决方案,并且在现有技术中被完备记录。你需要一个有制剂经验的专家来解释制剂选择是怎样被熟知,标准选择以及面对手边的问题时一个普通技术水平的配方师将会选择专利的剂型。
(3)仔细考虑非侵权理论的化学和权利要求解读。如我们所见,配方专利可以围绕着设计。奥美拉唑案例中的KUDCo成功地做到了这一点,但是其他仿制药措手不及地被简单但未料到的就在他们眼前发生的化学反应击败。因此,即使在一切都似乎直接的情况下,必须考虑所有的可能性,在所有现实的(甚至是不现实的)权利要求解读和可能的化学相互作用
对于专利持有人,应该记住以下:
(1)配方专利有着高无效率,有时约70%。
(2)你需要一个能够清楚且可信地解释为什么一个似乎简单和显而易见的配方选择并非如此的专家。避免费解或违反直觉的解释。
(3)你的作证专家也许需要依靠测试或实验来建立帮助确认侵权的化学相互作用。如果有任何关于测试或实验结果的质疑,在知会作证专家之前,应寻求另外的非作证专家来进行测试或实验。
方法/用途专利
此类专利指向使用药物的方法且可以涵盖特定适应症或药物滴定时间。有时仿制药企能在第IV段证明中具体指明公司申报的仿制药不会侵犯专利,是因为仿制药将不会按照专利涵盖的用途出售,但仅用于参考上市药物已被批准的另外一个适应症(所谓的第viii部分剥离或瘦身标签)。
治疗专利指向药物的使用方法。药物标签指明药物怎样使用,如指示通过药物和给药方案来治疗的特定状况。因此,关于使用药物治疗标签上指示的疾病的方法的专利可被使用药物治疗那种疾病的个人(如医生)侵权。在这种情形下,使用药物的个人为直接侵权者。药物制造商可被认为对诱导侵权承担责任,如果它的药品标签指引药物被以侵权方式使用。诱导侵权的因素包括第三方直接侵权的证据和鼓励第三方侵权的具体意图。但是在专利挑战诉讼中,通常仿制药尚未上市,所以没有第三方的实际直接侵权,且诱导分析集中在仿制药企寻求的批准范围按照仿制药提议标签所描述。仿制药企可通过只寻求FDA批准一种未被橙皮书列出的治疗专利所涵盖的使用方法来避免被发现诱导,这就是所谓的第viii部分剥离标签或薄标签。这个策略可以有效地使仿制药企免于被发现诱导。这非常不顾现实,一旦仿制药被出售, 医生可自由开出用于没有在批准的仿制药标签上具体指出的用途的处方,并且这种标示外应用也许会侵犯橙皮书列出的权利。
侵权:比较瑞舒伐他汀和布地奈德案例
如果一个仿制药标签能够合适地剥离被一个治疗专利所涵盖的治疗,一般不会诱导侵权。瑞舒伐他汀(专利药商品名 Crestor, 可定)就是这样的案例。一个专利的批准的瑞舒伐他汀用途是治疗杂合的家族性高胆固醇血症(heterozygous familial hypercholesterolemia, HeFH)。一项未授专利但是也获批的用途是治疗纯合子家族性高胆固醇血症(homozygous familial hypercholesterolemia, HoFH)。因为仿制药已经通过剥离授予治疗专利的HeFH适应症创立了一个薄标签,留下未授专利的HoFH适应症,法院认为仿制药没有诱导第三方用于治疗HeFH,即使都理解医生将会为专利药标签上的所有适应症开出仿制药处方。
一个对比的案例是Apotex挑战AstraZeneca,试图绕开一个治疗专利,该专利指向一种治疗呼吸疾病的方法,布地奈德每日给药不超过一次。专利药标签描述了每日一次和每次二次给药。仿制药剥离出每日一次给药,但保留推荐起始剂量为“每日总剂量0.5毫克,分两次给药”,并且被要求保持FDA的强制推荐,滴定到最低有效剂量。法院认为侵犯了治疗专利,结论如下:
(1)以每日给药两次,总剂量0.5毫克开始,下调滴定将必然导致每日一次使用0.25毫克小瓶装布地奈德仿制药。
(2)仿制药的标签不可避免地引起一些使用者操作专利权利要求的每日给药一次的治疗。
无效治疗专利:奥美拉唑案例
一个专利权利要求会因缺乏新颖性而无效,如果单个现有技术参考透露了每个权利要求的限制,不论明确地或者内在地。一种治疗专利被成功无效的方式是展示使用继承现有技术的活性成分根据治疗专利治疗病人,即使在当时未被认出。一个指向对于一种活性成分先前已知的作用机制的专利易于受到预期发现的攻击。接下来,我们再看看先前关于奥美拉唑的案例。
现有技术透露奥美拉唑可治疗溃疡,随后发现溃疡和幽门螺杆菌(H. pylori)感染相关。以奥美拉唑治疗溃疡性幽门螺杆菌感染随后被专利化,随后幽门螺杆菌治疗专利权利要求被认为因预期而无效,因为现有技术展示奥美拉唑可治疗溃疡,并且是因为这些溃疡中含有幽门螺杆菌感染,虽然当时未认识到奥美拉唑内在地治疗幽门螺杆菌感染。
由瑞舒伐他汀、布地奈德和奥美拉唑案例得到的提示
对于专利挑战者,当挑战治疗专利时须记住以下:
(1)第viii部分剥离是防止发现治疗专利侵权的有效护盾,尽管事实是一旦仿制药上市,医生为专利药标签上的所有适应症,包括专利适应症,开仿制药处方。
(2)然而法院会看仅是过去的标签冗词来看仿制药标签适应症是否真地引起第三方侵犯治疗专利。
(3)为使第viii部分剥离有效,必须确保仿制药的标签既不明确也不内在地为第三方指出操作治疗专利权利要求的方式。
(4)必须审查现有技术中药物的老用途,因为如果专利的治疗内在于现有技术,治疗的权利要求也许因为预期而被无效。
对于专利持有人,应该做到以下:
(1)努力确保起草的专利权利要求,以避免参考旧的使用机理,即一种在现有技术参考中明确地或内在地透露的药物作用机制。
(2)尽管第viii部分剥离,仔细地检查仿制药标签以避免争论标签表述会内在地诱发第三方操作治疗权利要求。
总结与展望
根据德勤的最新研究,创新药研发收益率从2010年至2018年呈明显下降趋势,从2010年的10.1%降低到2018年1.9%。成功研发并上市一个创新药的平均成本从2010年的11.88亿美元上升到2018年的21.68亿美元。从以上美国专利挑战的制度和案例介绍来看,专利挑战的本质就是仿制药利用法规在专利药的剩余专利保护期内独家上市仿制药,抢占专利药的部分市场。相对于专利药动辄十亿规模的投入,仿制药的工艺开发、申报、诉讼费用基本可忽略不计。挑战成功后在黄金180天独占期内几乎是以“准新药价格+几乎无成本”在销售。如没有足够的资金和/或技术实力,通过相对低成本、相对容易的专利挑战获取一定收益不失为一种商业策略。中国药企近几年来也逐渐开始尝试专利挑战国外知名药企,战果相当辉煌,给产业树立了榜样。

Table 2. 中国药企近几年重要专利挑战事件
中国近年来为专利挑战制度做了一些铺垫,早在2017年5月的55号文提出建立药品专利链接制度,10月又提出探索建立药品专利链接制度,2018年4月国务院20号文提出完善药品知识产权保护。中国的药物审评审批经过一系列政策的优化,已经提高到了前所未有的速度。优先审评制度为专利挑战做好了准备,诉讼后通过快速审批,迅疾上市,享有180天独占期已完全可能。当然独占期可根据中国市场情况进行调整。专利挑战成功后上市的仿制药可以通过医保动态调整制度,迅速进入医保放量,惠及大众。
参考文献
Lecture on Discoveries and Inventions.
http://www.abrahamlincolnonline.org/lincoln/speeches/discoveries.htm
Updated trends in US brand-name and generic drug competition. Journal of Medical Economics 2016; http://dx.doi.org/10.1080/13696998.2016.1176578
Unlocking R&D productivity Measuring the return from pharmaceutical innovation 2018. Deloitte Centre for Heath Solutions
Pharmaceutical Patent Litigation Strategies. Lexis Practice Advisor Journal. 2008-06-22
CDE发布的这个通知有大意图,首仿成功享受1~3年独占期?
https://news.pharmacodia.com/web/informationMobileController/getMobileNewInformationById?id=8a2d98375f383806015f3eb2735a0162
药品专利制五大玩法,影响所有药企
http://news.pharmnet.com.cn/news/2018/04/23/495567.html
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











翻译不走心
0
#仿制药#
56
谢谢分享,学习了
98
了解一下,谢谢分享!
103