Cell:新靶点Serpin B9直接介导肿瘤杀伤和癌症免疫治疗
2020-12-03 黎元 医药魔方Pro
梅斯医学小编注:肿瘤的治疗当前的主要前沿是新的靶点的发现,一个优秀靶点发现可能成就一系列创新药物。而靶点又分为突变靶点,异常表达的biomarkers。一般认为肿瘤特异性突变的靶点,是最佳的选择,如E
梅斯医学小编注:肿瘤的治疗当前的主要前沿是新的靶点的发现,一个优秀靶点发现可能成就一系列创新药物。而靶点又分为突变靶点,异常表达的biomarkers。一般认为肿瘤特异性突变的靶点,是最佳的选择,如EGFR,ALK,BRAF等突变。但是异常表达,也可能具有价值,如EGFR,VEGFR,CD20,CD19,CD47,CD38等。这项研究给我们带来新的靶点Serpin B9,有兴趣的研究者可以进一步追踪。Serpin B9是比较有意思的靶点,未来可能具有成药的潜力。当然,除Serpin B9外,其它类别的Serpin也可能具有价值。例如在2014年一篇报道认为Serpin是肿瘤脑转移的关键因子,见Cell:癌症细胞如何成功实现脑转移?
丝氨酸蛋白酶抑制剂(serpins)参与调节机体内许多重要的生命过程。先前已有研究证明SerpinB9(Sb9)可以保护肿瘤细胞免受颗粒酶B(GrB)诱导的细胞凋亡,Sb9是GrB的生理抑制剂,GrB在被细胞毒性淋巴细胞递送到靶细胞后能引发细胞凋亡,但是这种保护作用还需要在体内研究中进行综合分析。
11月25日,在Cell上发表的一项最新研究中,来自美国哈佛医学院、干细胞研究所等机构的研究人员发现SerpinB9具有将肿瘤消融、肿瘤微环境(TME)调控和免疫疗法结合起来的潜力。研究人员筛选出了一种特异性Sb9小分子抑制剂,该分子能有效控制肿瘤生长,无脱靶作用,也无显著的毒性作用。
来源:Cell
在本项研究中,研究人员在人类和小鼠的多种肿瘤(原发性黑色素瘤、乳腺腺癌和肺腺癌)中观察到Sb9和GrB的表达。而且Sb9通过经典的丝氨酸蛋白酶抑制剂机制抑制GrB,导致小鼠黑色素瘤细胞(B16)中产生SDS抗性的62 kDa Sb9-GrB复合物。
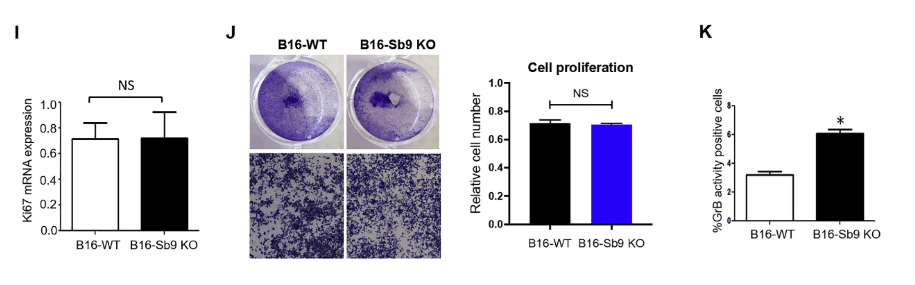
研究人员使用CRISPR/Cas9系统破坏了SERPINB9基因后,发现敲除Sb9对B16细胞的增殖没有影响,但导致GrB活性增加了2倍,GrB诱导的特异性凋亡增加了2.3倍,这表明Sb9参与保护肿瘤免受GrB诱导的细胞凋亡。
来源:Cell
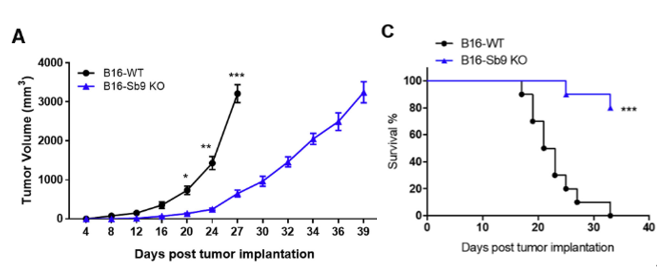
为了探究Sb9在体内肿瘤进展和转移中的作用,研究人员将野生型(WT)和敲除Sb9的B16细胞注射到小鼠模型中。在植入后第27天,Sb9缺失的肿瘤比WT组的肿瘤约小4倍,而且荷瘤小鼠中,肿瘤Sb9缺失组的中位生存时间(MST)比WT组肿瘤小鼠的中位生存时间显著更长。
来源:Cell
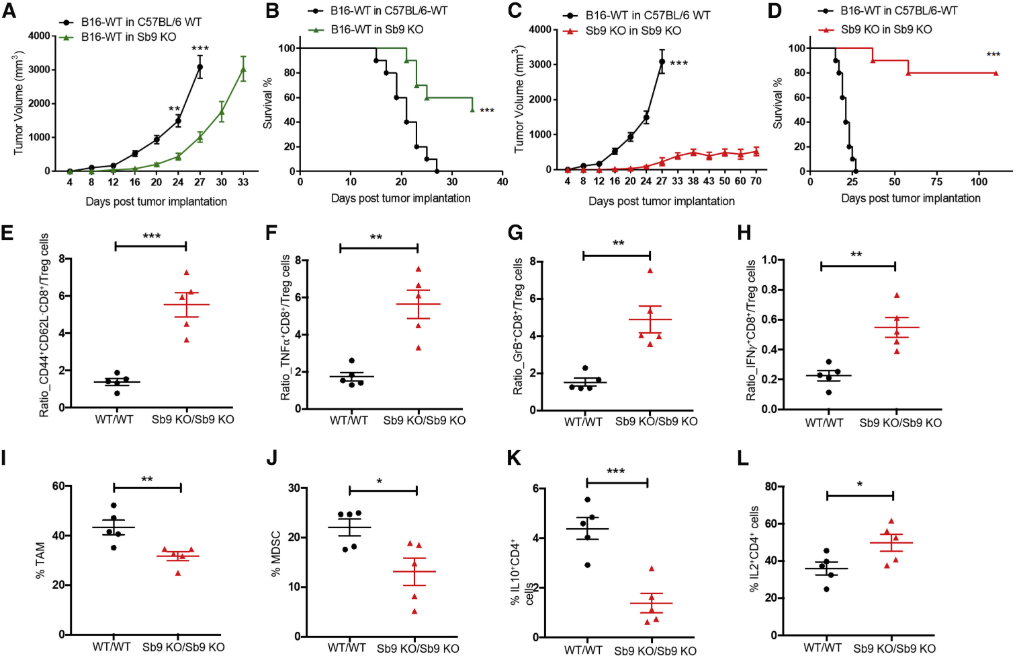
然而,研究人员没有观察到WT和敲除Sb9的肿瘤细胞之间在Treg、TAM(M1和M2)和MDSC水平上的差异,这表明肿瘤Sb9的表达对TME中免疫抑制细胞群的比例影响很小。而肿瘤引流淋巴结(TDLN)中的黑色素瘤细胞水平下降,证明Sb9缺失肿瘤的转移也减少了。
接下来,研究人员敲除了小鼠的Sb9,发现与WT小鼠相比,Sb9缺失小鼠的肿瘤生长更慢,中位生存时间显著更长。此外,当肿瘤和宿主均缺失Sb9时(Sb9 KO/Sb9 KO),能最大程度地防止肿瘤发展,而且肿瘤微环境中的效应CD8 T细胞与Treg、效应记忆CD8 T细胞与Treg等细胞的比例显著高于WT/WT组,Sb9 KO/Sb9 KO组的TAM和MDSC的水平也显著低于WT/WT组。
来源:Cell
研究人员将这种观察结果总结为Treg、TAM和MDSC中Sb9的缺失使其暴露于TME中GrB介导的杀伤,最终导致抗肿瘤免疫应答的恢复和肿瘤进展的抑制。
3034是研究人员筛选出来的一种能与Sb9直接结合的具有优良性能的小分子化合物,能以剂量依赖的方式降低B16细胞Sb9-GrB复合物的表达。在体内实验中,与对照组相比,3034的注射后,小鼠肿瘤免疫力显著提高,植入腹侧的B16肿瘤的显著减小,而且免疫抑制Treg、TAM和MDSC的水平显著降低。
为了评估3034的抗肿瘤作用是否可以推广到人类患者中,研究人员还测试了3034在人源化黑色素瘤小鼠模型中的功效。结果显示,与对照组相比,3034显著缩小了肿瘤大小。而且3034能在B16细胞中诱导GrB介导的凋亡,3034处理的B16细胞中GrB的活性增加,而且3034无脱靶作用,也无显著毒性作用。

来源:Cell
总的来说,这项研究突出了Sb9在抑制肿瘤转移中的重要性,抑制Sb9可能是一种比免疫检查点抑制的更有效、更安全的疗法。不过,未来需要开展更多的研究来表征和优化Sb9抑制剂在体内结合的亲和力和功效。
参考资料:
Liwei Jiang, et al. Direct Tumor Killing and Immunotherapy through Anti-SerpinB9 Therapy. Cell (2020)
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#CEL#
105
#Cell#
92
#RPI#
84
#新靶点#
130
学习了,涨知识了!
109