ATVB 浙二医院内分泌科郑超团队发现GLP-1(32-36)非胰岛素依赖的促糖尿病下肢血管新生新作用
2024-06-05 论道心血管 论道心血管 发表于上海
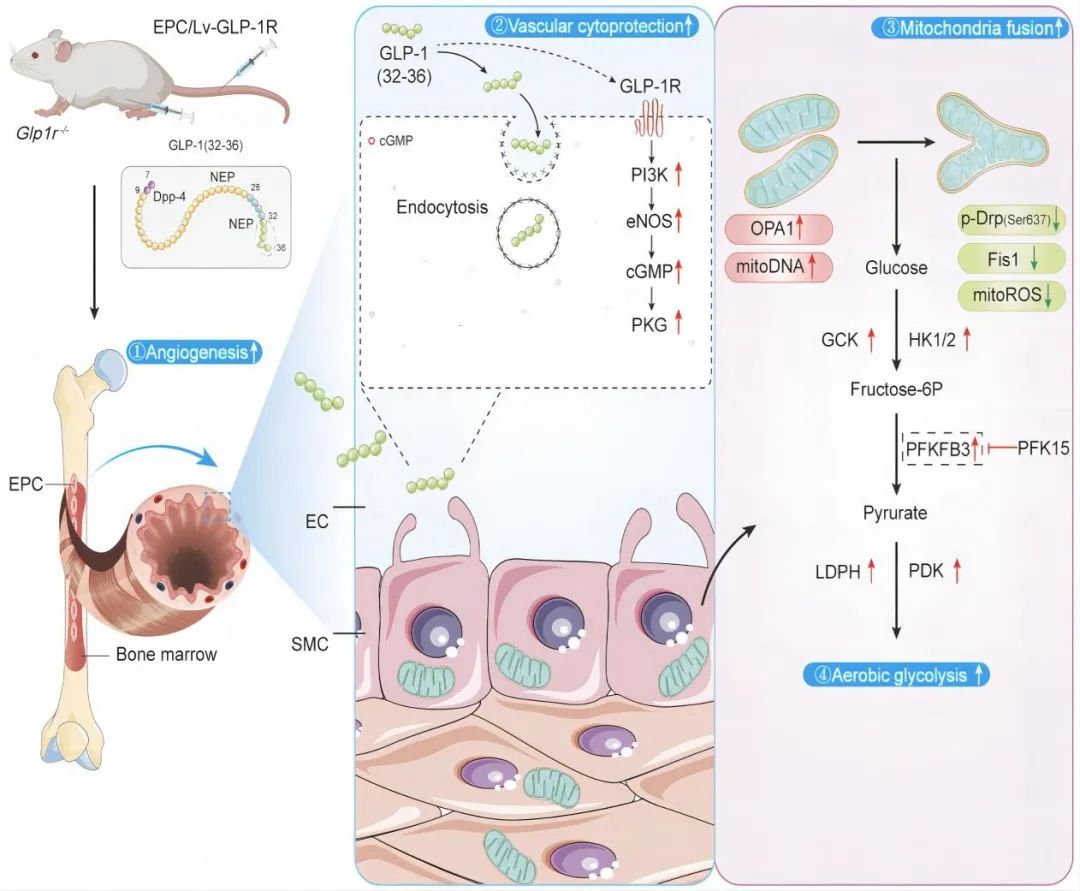
发现并揭示了GLP-1通过GLP-1R调节PFKFB3介导的糖酵解水平,以改善高糖暴露的内皮祖细胞和T1DM小鼠模型的血管生成,而这一作用并不依赖于胰岛素释放。
外周动脉疾病(PAD)是糖尿病的严重慢性并发症,其特征是供应下肢的动脉狭窄和闭塞。鉴于糖尿病患者发生PAD的风险是一般人群的4倍,高血糖与血管并发症之间可能存在密切关系。最近的研究表明,肠促胰素如GLP-1(胰高血糖素样肽-1)具有调节血管生成方面的作用。
GLP-1是一种天然存在的激素,通过刺激胰岛素分泌在调节葡萄糖稳态中起着至关重要的作用。GLP-1(32-36)是GLP-1蛋白水解的主要终产物,已被发现可以减轻肥胖小鼠的体重,增加能量消耗,并减少β细胞凋亡。然而,GLP-1(32-36)是否对糖尿病血管内皮损伤有有益作用尚不清楚。
2024年3月21日,浙江大学医学院附属第二医院郑超主任团队在Arteriosclerosis, Thrombosis, and Vascular Biology (ATVB)杂志在线发表题为“Novel Angiogenesis Role of GLP-1(32–36) to Rescue Diabetic Ischemic Lower Limbs via GLP-1R–Dependent Glycolysis in Mice”的研究论文,发现并揭示了GLP-1(32-36)通过GLP-1R调节PFKFB3 (6-磷酸果糖-2-激酶/果糖-2,6双磷酸酶3)介导的糖酵解水平,以改善高糖暴露的内皮祖细胞(EPCs)和T1DM小鼠模型的血管生成,而这一作用并不依赖于胰岛素释放。

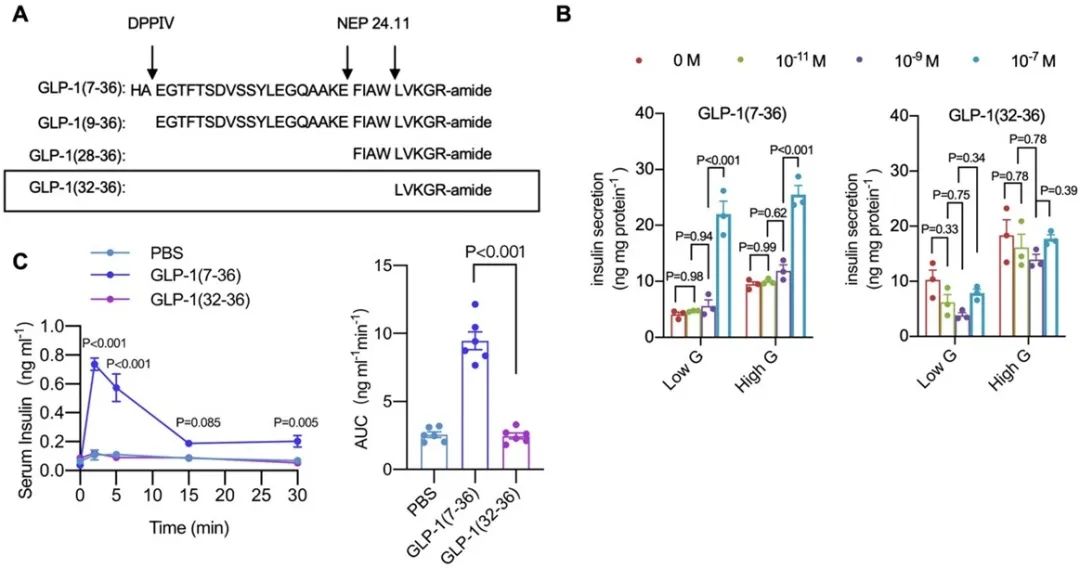
本研究首先证明了GLP-1(32-36)在体外INS-1细胞和小鼠体内均不促进胰岛素释放。
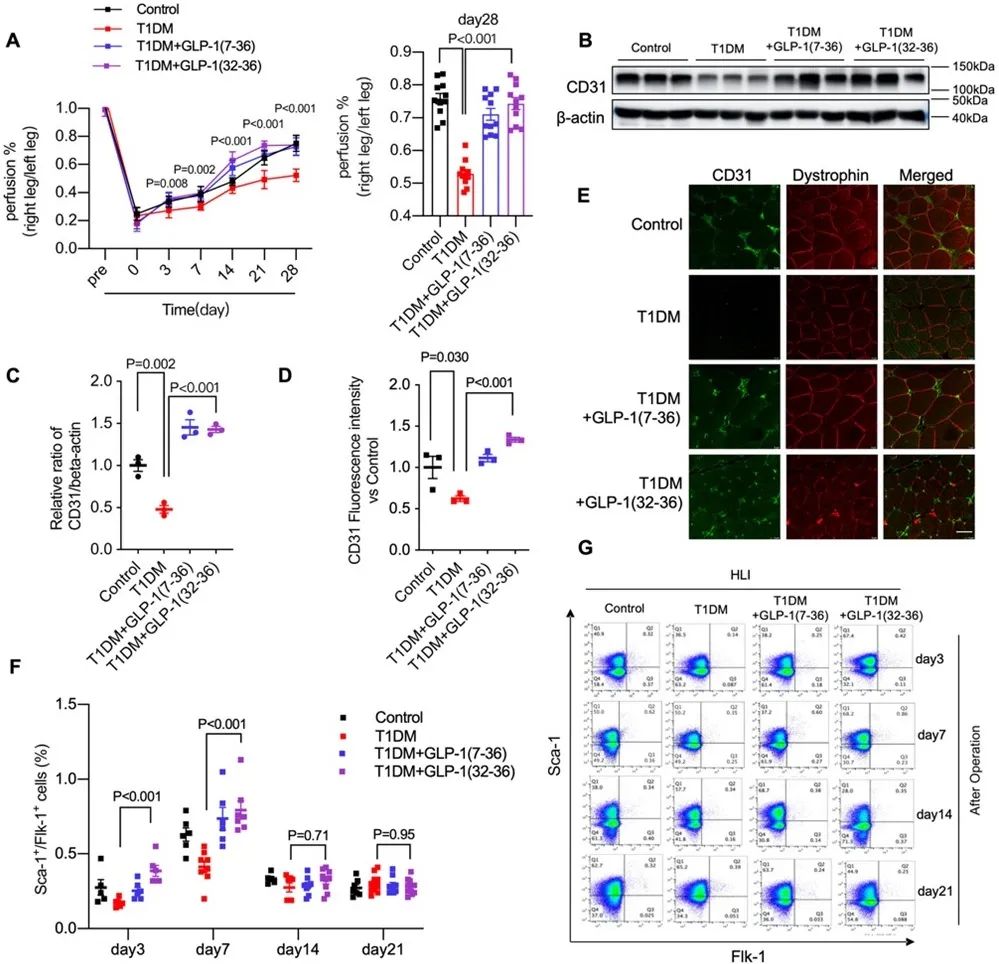
在1型糖尿病小鼠中,GLP-1(32-36)处理可以明显增强缺血组织的血流灌注,并促进EPCs向外周血迁移。
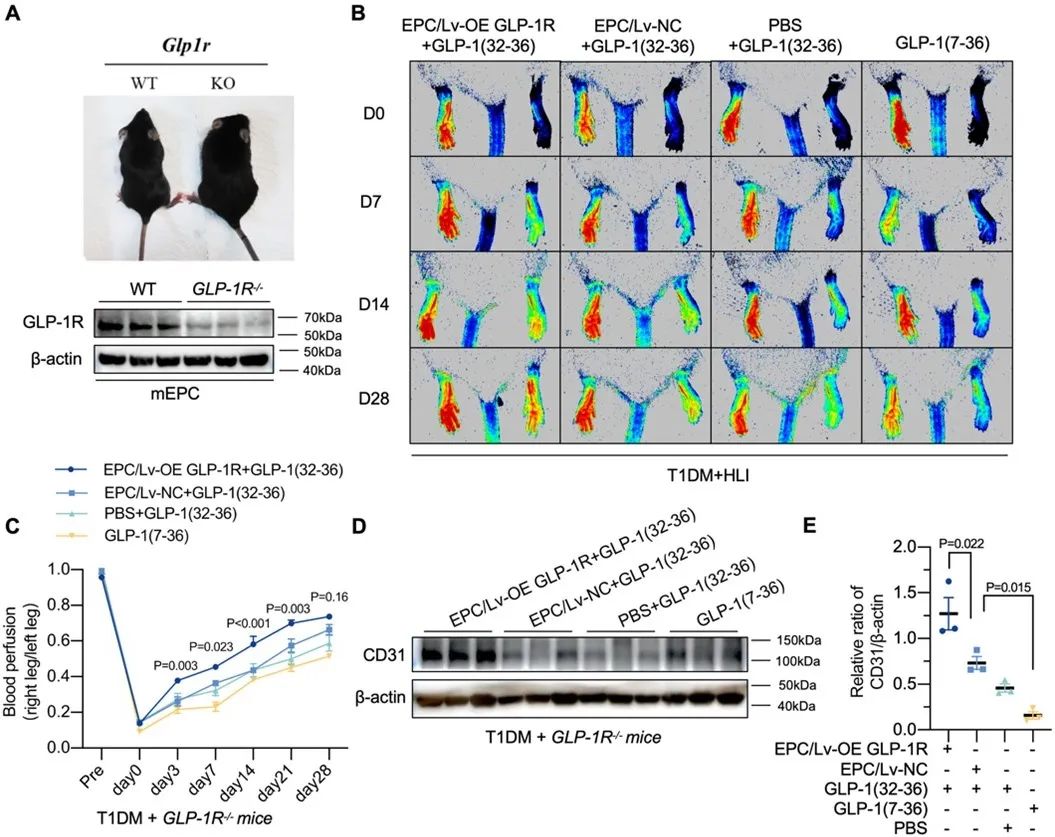
在小鼠骨髓原代EPCs中,GLP-1(32-36)改善了线粒体动力学,并挽救了由PFKFB3介导的糖酵解。在同样给予GLP-1(32-36)处理的条件下,敲除GLP-1R基因的T1DM小鼠表现出受损的血管生成能力,而在回补GLP-1R表达后血管新生能力恢复,提示GLP-1(32-36)的作用依赖于GLP-1R。
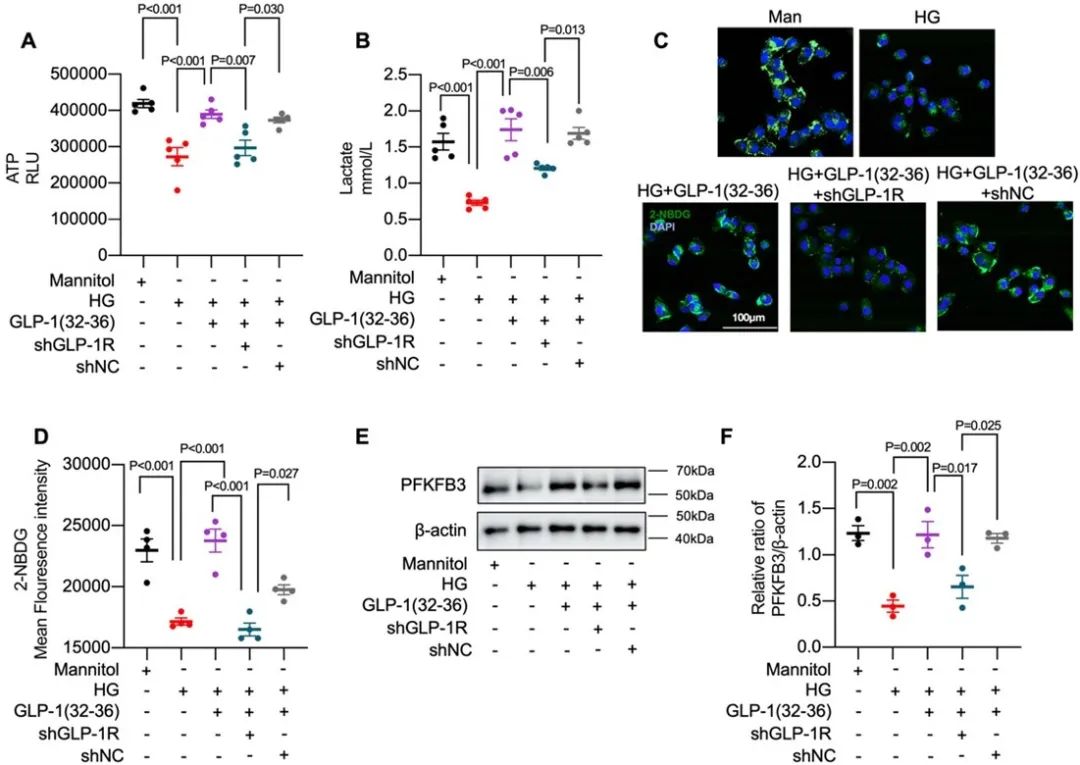
沉默GLP-1R基因抑制了GLP-1(32-36)对eNOS/cGMP/PKG途径的激活,并进一步抑制了细胞的成管、迁移及NO合成。同时,沉默GLP-1R抑制了GLP-1(32-36)介导的糖酵解,阻断了细胞的ATP、乳酸生成,降低了细胞的葡萄糖摄取。
综上,本研究为GLP-1(32-36)对PAD促血管新生机制提供了新的见解,并强调了其对非糖尿病患者的潜在治疗价值。
浙江大学医学院附属第二医院内分泌科张亦凯、浙江大学医学院在读博士生王声遥为论文共同第一作者。浙江大学附属第二医院郑超主任为通讯作者。
文章链接:
https://pubmed.ncbi.nlm.nih.gov/38511325
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言


















学习了,谢谢分享
0
#糖尿病# #GLP-1#
77