友芝友生物PD-L1/TGF-β双特异性抗体新药获得美国FDA临床试验批准
2021-01-24 动脉网 动脉网
2021年1月23日,武汉友芝友生物制药有限公司(以下简称“友芝友生物”)自主研发的“重组抗PD-L1和TGF-β双特异性抗体注射液”(代号:Y101D),获得美国食品药品监督管理局(FDA)批准在美
2021年1月23日,武汉友芝友生物制药有限公司(以下简称“友芝友生物”)自主研发的“重组抗PD-L1和TGF-β双特异性抗体注射液”(代号:Y101D),获得美国食品药品监督管理局(FDA)批准在美国进行临床试验,开展针对局部晚期或转移性肿瘤的临床研究。这是友芝友生物继M802、M701和Y150之后,获得美国FDA批准开展临床的第四个双特异抗体新药。
免疫治疗是对肿瘤最有前景的治疗方法之一。PD-1/PD-L1单抗因抗癌谱广、疗效持久、副作用易耐受而备受瞩目,但是其响应率局限在大约20%肿瘤病人。为了让更多的患者对这些免疫疗法产生响应,很多试验正在评估抗PD-1 / PD-L1与其他靶点结合的联合疗法或者双特异抗体研发。肿瘤微环境中的TGF-β信号促进肿瘤进展,也是公认的免疫抑制因子。临床前研究已经证实了PD-L1和TGF-β途径之间可能存在互补相互作用,通过同时阻断两个免疫抑制信号通路,解除免疫系统的抑制状态,有望唤醒和恢复机体的抗肿瘤反应,从而起到控制肿瘤生长的效果。
利用友芝友生物自主专利四价对称双特异性抗体CHECK-BODY平台,开发的同时靶向PD-L1和TGF-β的新药Y101D,是第一个真正意义上的抗PD-L1和TGF-β双特异性抗体。与默克在研同靶点双功能融合蛋白M7824(Bintrafusp alfa)结构不同,Y101D双抗体具体结构为F(ab)2-(Fv)2-Fc,其中结合TGF-β端为抗TGF-b抗体的Fv结构,而M7824靶向TGF-β端的为受体TGFBRII的胞外区。前临床药学研究表明:Y101D抗体候选药物表达量高、稳定性好、糖型简单,并且在多种小鼠肿瘤模型中展示出显着的肿瘤抑制效果。
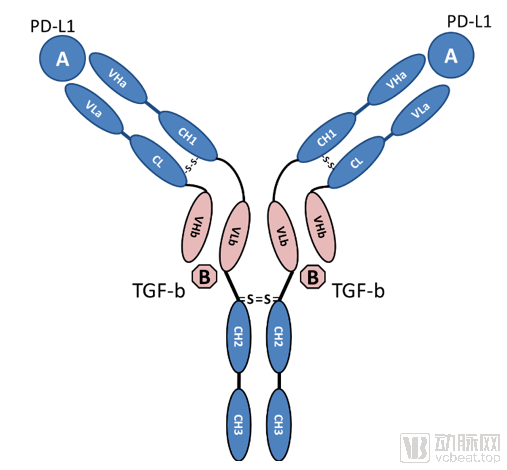
Y101D结构示意图
友芝友生物CEO周鹏飞博士表示:“友芝友生物是国内最早布局双抗药物的生物技术公司之一,在CD3招募类双特异抗体方面已经积累了较为丰富的经验。最近开发的新型四价对称双抗技术,可以广泛应用于双抗体药物的构建和设计。我们预期PD-L1/TGF-β双特异性抗体能有效的提高肿瘤免疫治疗的响应率,并拓宽PD-1/PD-L1免疫治疗适应症。”
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#TGF#
81
#特异性#
0
双特异性抗体是热点,但是也不一定都有效!
97
#PD-L1#
45
#TGF-β#
97
#特异性抗体#
53
#美国FDA#
70
#双特异性抗体#
170
好
0