Zeposia (ozanimod) 治疗中重度活动性溃疡性结肠炎成人患者,CHMP持积极意见
2021-10-17 Allan MedSci原创
百时美施贵宝近日宣布,欧洲药品管理局 (EMA) 的人用药品委员会 (CHMP) 已建议批准Zeposia (ozanimod) 用于治疗患有中度至重度活动性溃疡性结肠炎的成人患者。
百时美施贵宝近日宣布,欧洲药品管理局 (EMA) 的人用药品委员会 (CHMP) 已建议批准Zeposia (ozanimod) 用于治疗患有中度至重度活动性溃疡性结肠炎的成人患者,这些患者对常规治疗或生物制剂反应不足、失去反应或不耐受。Zeposia是一种每天服用一次的口服药物,是一种1-磷酸鞘氨醇 (S1P) 受体调节剂,以高亲和力选择性结合 S1P 亚型 1 (S1P1) 和 5 (S1P5)。
CHMP 根据 True North试验的数据采纳了这一积极意见,这是一项关键的 III 期试验,评估 Zeposia 治疗中度至重度活动性 UC 成人患者的有效性和安全性。该试验表明,在第 10 周和第 52 周,与安慰剂相比,Zeposia组患者的所有主要和次要疗效终点(包括临床缓解、临床反应、内窥镜改善和内窥镜组织学粘膜改善)均得到显著改善。
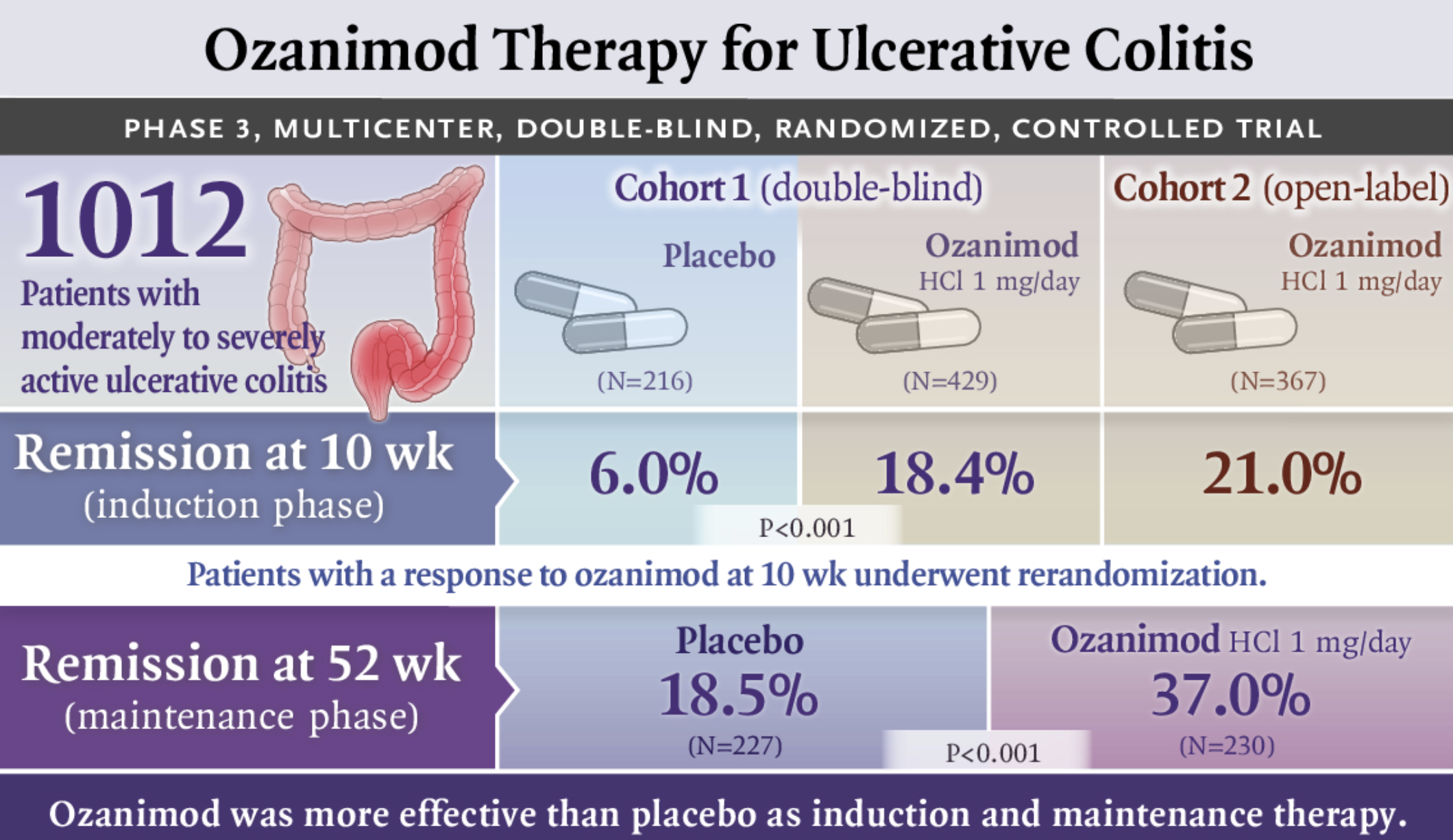
True North研究开始时,患者平均年龄为 42 岁,60% 为男性,平均病程为 7 年;不同治疗组的患者特征平衡良好。在为期 10 周的诱导研究(UC 研究 1)中,共有 645 名患者以 2:1 的比例随机接受 Zeposia(n=429)或安慰剂(n=216)。在诱导阶段没有观察到新的安全信号。
在 维持研究(UC 研究 2 )中,共有 457 名在 UC 研究 1 或开放标签组中接受 Zeposia 治疗并在第 10 周达到临床反应的患者按 1:1 重新随机分配,并接受 Zeposia 0.92 mg 治疗(n=230) 或安慰剂 (n=227) 42 周,总共治疗 52 周。在维持阶段,总体安全性与 Zeposia 和中重度 UC 患者的已知安全性一致。
美国食品和药品监督管理局于 2021 年 5 月 27 日批准 Zeposia 用于治疗患有中度至重度活动性溃疡性结肠炎的成人患者。
原始出处:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言













#活动性#
75
#溃疡性#
54
#活动性溃疡性结肠炎#
69
#CHMP#
105