Nature:基因KCTD13和孤独症、精神分裂症以及肥胖症直接相关
2012-05-19 T.Shen 生物谷
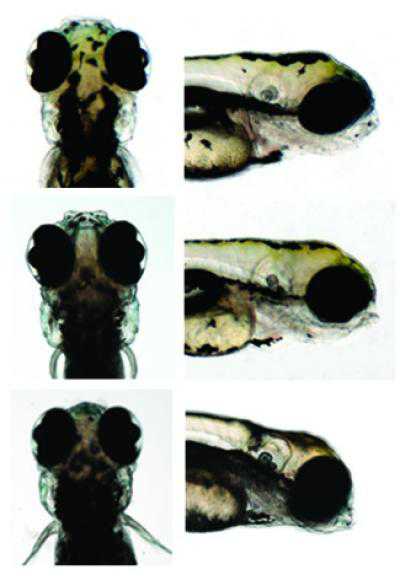
利用斑马鱼模型,研究者可以将一系列人类基因移植入斑马鱼体内,用来识别幼年斑马鱼头部尺寸的效应基因在斑马鱼体内的表达情况。(Credit: Christelle Golzio, Duke Center for Human Disease Modeling and Duke Department of Cell Biology) 一条斑马鱼能够告诉我们人类的大脑如何发育吗?近日,来自杜克大学医学中心

利用斑马鱼模型,研究者可以将一系列人类基因移植入斑马鱼体内,用来识别幼年斑马鱼头部尺寸的效应基因在斑马鱼体内的表达情况。(Credit: Christelle Golzio, Duke Center for Human Disease Modeling and Duke Department of Cell Biology)
一条斑马鱼能够告诉我们人类的大脑如何发育吗?近日,来自杜克大学医学中心的研究者将一系列人类基因移植入斑马鱼体内,用来识别婴儿头部尺寸的效应基因在斑马鱼体内的表达情况。婴儿的头部尺寸是孤独症的一个重要指标,当然了婴儿头部的尺寸大小也是一些主要神经性障碍疾病(如精神分裂症)的指标,在研究中心,研究者使用解剖学知识,使我们更清楚地理解神经发育的精确机制。相关研究成果刊登在了5月16日的国际杂志Nature上。
研究者Katsanis表示,16号染色体区域主要是孤独症和精神分裂症的发病区域,而且这个区域也和新生儿的头部尺寸大小相关。这个区域有大量的DNA缺失和复制,这是在人类中常见的突变,DNA的复制或者缺失常常牵扯到一些基因,但是这个区域中的许多基因都会引起患者的病理学表现。研究者所研究的这个区域的基因组可以以脑细胞生长的方式来产生信息交流的缺失,因此,研究者尝试着过表达基因,试图得到一种表型---头部尺寸变小,研究者将人类16号染色体上29个基因移植入斑马鱼胚胎中,使得每一个基因都进行表达,研究者观察,看哪种基因的表达可以使得斑马鱼的头部尺寸变小,然后研究者通过抑制基因功能,观察是否其中的某些基因可以引发相反的效应---头部尺寸变大。
研究者表示,16号染色体29个基因的缺失一般发生在1.7%的孤独症孩子中,不同基因的拷贝数的改变会导致染色体DNA部分的功能异常,因此,研究者从遗传学角度(剂量敏感性)出发,开始研究一些和神经系统识别特点相关的基因,神经系统的识别设计思考、记忆以及信息处理等的能力。Katsanis说,目前,在利用斑马鱼研究孤独症和精神分裂症上还有许多限制,但是他们可以测定头部尺寸,下巴尺寸以及面部的异常情况。
研究者表示,基因KCTD13可以通过调节斑马鱼的神经细胞的产生和衰亡来控制其头部尺寸,因此,研究者重点研究了人类的KCTD13基因,该基因和孤独症相关,也主要和精神分裂症以及儿童肥胖症相关。研究者检测了该基因表达的蛋白,随后对蛋白的功能进行了一系列研究;
基因拷贝数的变化,比如研究小组发现的16号染色体,被认为是常见的遗传突变的来源,随后研究者有在神经发育混乱的病人身上发现了数以百计的染色体基因缺失。如今研究者可以运用特殊有效的工具来研究如何改善诊断的能力以及理解及疾病的发病机制,当然了,研究者的焦点也在基因KCTD13上,该基因不但是孤独症的致病因素,也和其它基因相互协同作用,如MVP和MAPK3。研究者的研究由国立精神卫生研究所等机构支持。

doi:10.1038/nature11091
PMC:
PMID:
KCTD13 is a major driver of mirrored neuroanatomical phenotypes of the 16p11.2 copy number variant
Christelle Golzio, Jason Willer, Michael E. Talkowski, Edwin C. Oh, Yu Taniguchi, Sébastien Jacquemont, Alexandre Reymond, Mei Sun, Akira Sawa, James F. Gusella, Atsushi Kamiya, Jacques S. Beckmann & Nicholas Katsanis
Copy number variants (CNVs) are major contributors to genetic disorders1. We have dissected a region of the 16p11.2 chromosome—which encompasses 29 genes—that confers susceptibility to neurocognitive defects when deleted or duplicated2, 3. Overexpression of each human transcript in zebrafish embryos identified KCTD13 as the sole message capable of inducing the microcephaly phenotype associated with the 16p11.2 duplication2, 3, 4, 5, whereas suppression of the same locus yielded the macrocephalic phenotype associated with the 16p11.2 deletion5, 6, capturing the mirror phenotypes of humans. Analyses of zebrafish and mouse embryos suggest that microcephaly is caused by decreased proliferation of neuronal progenitors with concomitant increase in apoptosis in the developing brain, whereas macrocephaly arises by increased proliferation and no changes in apoptosis. A role for KCTD13 dosage changes is consistent with autism in both a recently reported family with a reduced 16p11.2 deletion and a subject reported here with a complex 16p11.2 rearrangement involving de novo structural alteration of KCTD13. Our data suggest that KCTD13 is a major driver for the neurodevelopmental phenotypes associated with the 16p11.2 CNV, reinforce the idea that one or a small number of transcripts within a CNV can underpin clinical phenotypes, and offer an efficient route to identifying dosage-sensitive loci.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#Nat#
48
#肥胖症#
70
#精神分裂#
67