Circulation:内皮细胞特异性LKB1敲除可致小鼠内皮功能不良及高血压
2014-03-31 佚名 dxy
LKB1(Liver kinase B1)是一种肿瘤抑制因子,它广泛表达于哺乳动物细胞,它通过与STE20相关受体蛋白及鼠蛋白20两种支架蛋白形成复合物而被活化。目前,LKB1被认为是多个系统中细胞极化和能量代谢中的一个中心调节因子,这个作用是通过它的磷酸化和活化AMPK蛋白家族(共包括14种蛋白)的能力实现的。 LKB1通过小窝蛋白-1调节eNOS活性及内皮功能的机制图 关于
LKB1(Liver kinase B1)是一种肿瘤抑制因子,它广泛表达于哺乳动物细胞,它通过与STE20相关受体蛋白及鼠蛋白20两种支架蛋白形成复合物而被活化。目前,LKB1被认为是多个系统中细胞极化和能量代谢中的一个中心调节因子,这个作用是通过它的磷酸化和活化AMPK蛋白家族(共包括14种蛋白)的能力实现的。【原文下载】
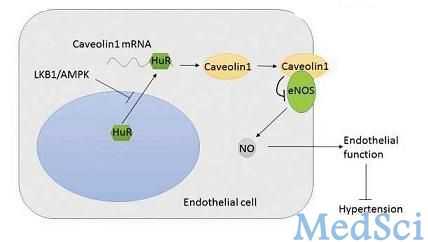
关于LKB1更进一步的机制已通过LKB1敲除小鼠模型得到证实。LKB1整体敲除会使小鼠在心血管发育中出现严重缺陷,从而导致胚胎死亡,说明LKB1心血管系统中具有重要作用。Mäkelä’s博士的团队将LKB1flox/flox小鼠与Tie1-Cre小鼠相杂交, 他们发现用Tie1启动子得到的纯合子LKB1敲除因血管损伤而导致小鼠胚胎死亡。

针对这种情况,来自美国俄克拉荷马大学医学院的华裔科学家邹明辉教授与西安交通大学第一附属医院心血管内科的袁祖贻教授带领他们的团队合作完成了一项研究,研究的目的是在消除非内皮LKB1敲除影响后评估LKB1在LKB1endo-/-小鼠中维持内皮功能和血压中的作用。研究结果在线发表于2014年3月17日的《循环》(Circulation)杂志上。
该研究是在内皮特异的LKB1敲除小鼠(LKB1endo-/-)身上进行的。LKB1endo-/-小鼠是通过LKB1flox/flox小鼠与VE-Cadherin-Cre小鼠杂交获得的。LKB1endo-/-小鼠表现出高血压、心脏肥大以及内皮源性舒张功能受损等一系列特征。与野生型细胞相比,LKB1endo-/-的内皮细胞抑制了内皮一氧化碳合酶(eNOS)的活性及AMP激活的蛋白激酶(AMPK;LKB1下游的酶)在Thr172位点的磷酸化。
此外,小窝蛋白-1的水平在LKB1endo-/-小鼠内皮细胞中也有所升高,而用siRNA敲除小窝蛋白-1则可使eNOS活性恢复正常。人类抗原R(HuR)可以与小窝蛋白-1 mRNA 3'端非编码区的富含AU序列(ARE-mRNA是3′-UTR区富含AU序列为特征的一类mRNA,它们在转录后水平受到多蛋白网络多层次的严密调控)相结合,从而引起小窝蛋白-1的稳定性增加,而HuR基因敲除则可以降低小窝蛋白-1在LKB1缺失的内皮细胞中的表达。
最后,腺病毒过表达的持续激活的AMPK(CA-AMPK)在LKB1endo-/-小鼠中减少了小窝蛋白-1,降低了血压,并改善了内皮功能,而绿色荧光蛋白(GFP)则无此效果。
研究结果表明,内皮LKB1可通过调节AMPK介导的小窝蛋白-1表达而调节eNOS活性,从而调节内皮功能及血压。
此项研究证实了LKB1敲除导致内皮功能失调及高血压的分子机制。LKB1的缺失使小窝蛋白-1表达增多,eNOS活性随之增加,与此同时,内皮功能和血压调节也受到不良影响。由于AMPK活化可以有效增加LKB1敲除的效果,AMPK可能成为抗高血压治疗的一个新靶点。
原始出处:
Zhang W1, Wang Q, Wu Y, Moriasi C, Liu Z, Dai X, Wang Q, Liu W, Yuan ZY, Zou MH.Endothelial Cell-Specific LKB1 Deletion Causes Endothelial Dysfunction and Hypertension in Mice in vivo.Circulation. 2014 Mar 17.【原文下载】
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








赞
38
#特异性#
46
#细胞特异性#
97
#内皮功能#
56
#LKB1#
101