Radiology:如何实现TARE对乳腺癌肝转移患者的影像学治疗评估?
2023-01-11 shaosai MedSci原创 发表于上海
虽然超过70%的乳腺癌患者对TARE取得了代谢性影像学反应,而且早期影像学反应与延长生存期有关,但其疗效仍有局限性。

现阶段,钇90经动脉放射栓塞术(TARE)是治疗乳腺癌肝转移(BCLM)的一种新兴疗法。TARE治疗BCLM主要用于治疗多灶性难治性肝病,与化疗栓塞相比,TARE有更好的临床预后及更少的毒副作用。虽然超过70%的乳腺癌患者对TARE取得了代谢性影像学反应,而且早期影像学反应与延长生存期有关,但其疗效仍有局限性。首先,没有可靠的指标可以预测哪些患者会在TARE后获得影像学反应或存活更长时间。其次,反应持续的时间中位数为6个月,但大多数病人随后会出现肝脏进展。解决这些限制的一个策略是探索TARE诱导局部和全身抗肿瘤免疫的潜力。通过定义对BCLM进行的TARE的抗肿瘤免疫反应,可以为潜在的联合治疗提出免疫治疗目标以增加和延长TARE的疗效,并可通过scopopal效应诱发免疫介导的肝外反应。
近日,发表在Radiology杂志的一项研究评估了在进行TARE治疗BCLM后免疫标志物水平的变化,并探讨了TARE的代谢成像反应与免疫标记物之间的关系。
本项前瞻性试验研究招募了23名计划接受TARE的BCLM女性(2018年6月至2020年2月)。在基线和TARE后1-2个月收集了外周血和肝脏肿瘤活检结果。利用基因表达研究和流式细胞术评估单核细胞、骨髓源性抑制细胞(MDSC)、白细胞介素(IL)和肿瘤浸润淋巴细胞(TIL)水平,利用免疫组织化学评估免疫检查点和细胞表面标志物水平。使用修改后的实体瘤PET反应标准来确定治疗组织的完全反应(CR)。
共20名妇女被纳入研究。TARE后,外周IL-6(几何平均数,1.0 vs 1.6皮克/毫升;P = .02)、IL-10(0.2 vs 0.4皮克/毫升;P = .001)和IL-15(1.9 vs 2.4皮克/毫升;P = .01)增加。在活检组织中,淋巴细胞激活基因3阳性的CD4+ TILs(15% vs 31%;P < .001)增加。20名参与者中有8人(40%[确切的95%CI:19,64])实现了CR。获得CR的参与者在流式细胞术中具有较低的外周单核细胞(10% vs 29%;P < .001)和MDSCs(1% vs 5%;P < .001),以及较高的程序性细胞死亡蛋白(PD)1阳性CD4+ TILs(59% vs 26%;P = .006),肿瘤中PD-1+染色较高(2% vs 1%;P = .046)。
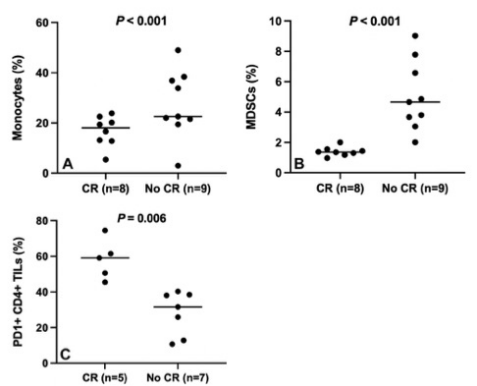
图 按反应状态划分的基线免疫细胞水平。图中按反应状态显示(A)单核细胞、(B)骨髓源性抑制细胞(MDSC)和(C)程序性细胞死亡蛋白1(PD1)阳性的CD41肿瘤浸润淋巴细胞(TIL)值,横线代表平均值。CR=完全反应
本研究表明,经TARE治疗乳腺癌肝转移会诱发炎症和免疫效应。细胞因子和免疫抑制性外周骨髓源性抑制细胞的水平较高,与对TARE的反应较差有关,因此可作为评估预后的重要标志物。同时发现,肿瘤微环境中程序性细胞死亡蛋白(PD)1的水平与对TARE的反应有关,这一发现表明针对PD-1和程序性死亡配体1途径的联合疗法有可能增强对TARE的反应,这为下一步的治疗提供了重要的信息。
原文出处:
Amy R Deipolyi,C Bryce Johnson,Christopher C Riedl,et al.Prospective Evaluation of Immune Activation Associated with Response to Radioembolization Assessed with PET/CT in Women with Breast Cancer Liver Metastasis.DOI:10.1148/radiol.220158
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言