【Eur Respir J.】发育性肺疾病中肺动脉高压的跨学科共识-诊断评估
2024-08-19 肺动脉高压研究进展 肺动脉高压研究进展 发表于上海
介绍发育性肺疾病的诊断评估,包括影像学检查、基因检测、肺活检等方法,强调多学科协作,阐述其应用、选择与挑战。

发育性肺疾病(DEVLD)的诊断评估,目前的现实问题:
-
缺乏正式的工作流程指南
-
对“最佳测试”的不确定性
-
对检测时间(基因检测、活检)的不清晰
-
各中心检测手段和专业知识的可用性差异
诊断研究,肺部影像学表现;如何通过影像学手段诊断新生儿或婴儿的DEVLD?该如何进行影像检查,什么时候进行?正常的影像结果是否能排除疾病?
在某些情况下,产前超声可以检测到肺部异常,并通过先进的影像技术(如胎儿磁共振成像[MRI])更好地定义解剖结构,并在肺发育不全的情况下进行量化评估。然而,对于新生儿或患有呼吸衰竭的儿童来说,不论产前信息如何,初步检查通常是胸部的普通X线片。X线片可以大致评估肺容量和心脏大小,并显示弥漫性或局灶性的肺不透明度,或并发症如气胸等。
通常,当婴儿的临床病程与预期的疾病严重程度不符时,会进行胸部计算机断层扫描(CT)。胸部CT目前是儿科胸腔影像学的标准方法,首选用于显示肺实质的细节。通过薄层、高分辨率图像的重建,可以更好地捕捉肺实质的细微结构,这有助于区分不同的疾病状态。虽然静脉注射造影剂通常不用于肺实质的评估,但如果怀疑存在心脏或肺血管的解剖异常、气道结构的血管压迫或肺静脉狭窄(PVS),则应使用造影剂。
在评估疑似DEVLD的儿童时,还应考虑对胸腔外器官进行影像学检查,以评估是否存在相关的异常,例如胃肠系统(ACD)、骨骼系统(TBX4)或神经系统(ACD、Filamin A、TTF-1/NKX2-1)。
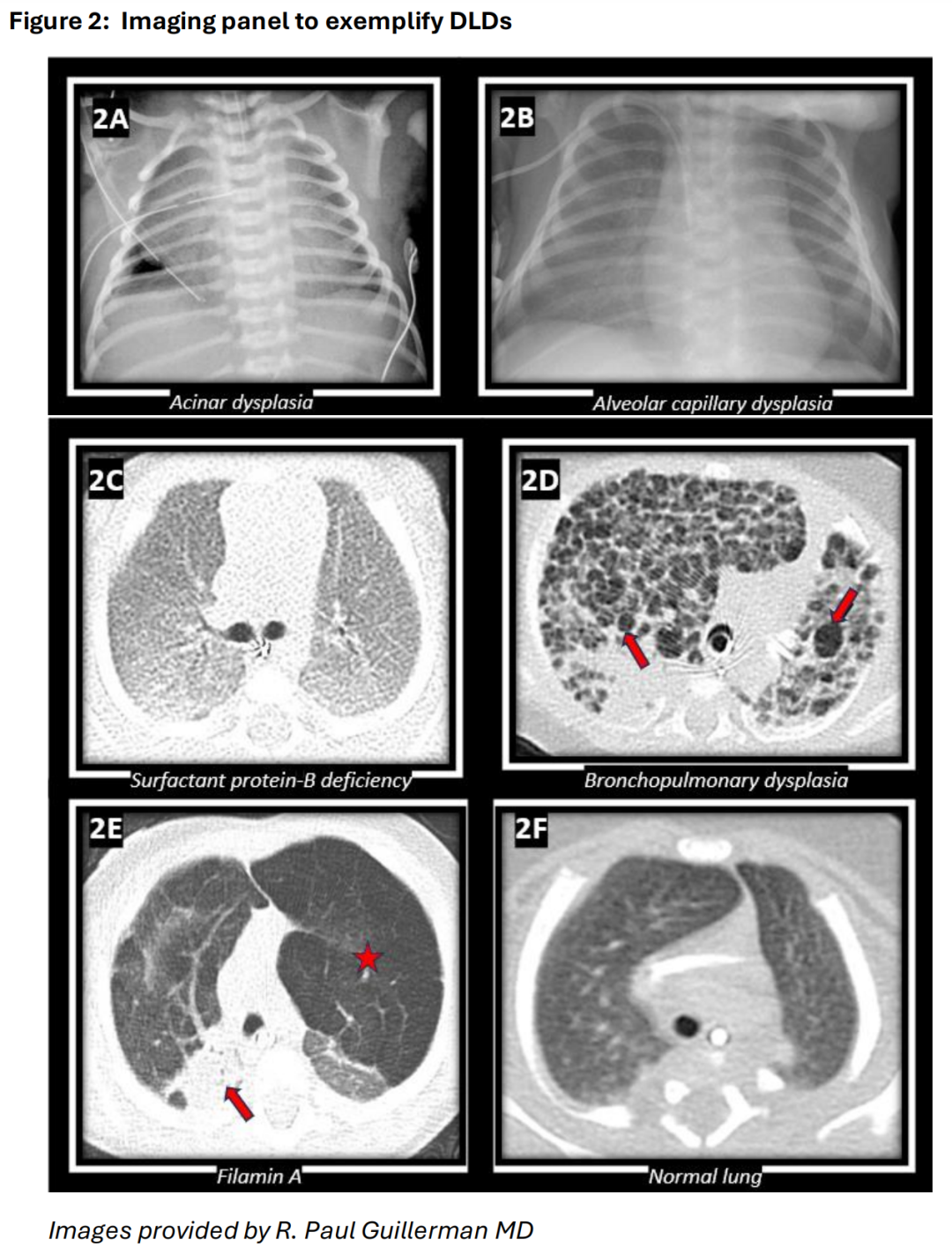
图 2:用于举例说明 DLD 的成像。A. 一名1天大的38周胎龄新生儿,患有左心发育不全综合征,伴随腺泡发育不良导致的肺容积小(仅为预期值的45%)。胸部X光显示肺容积小,以及右侧胸腔放置的胸管用于治疗气胸。小肺容积和气体泄漏在弥漫性发育性肺疾病(如腺泡发育不良)中常见。B. 一名3周大的足月新生儿,因先天性肺静脉回流异常(ACD)导致的低氧血症和肺动脉高压。胸部X光显示弥漫性肺部浑浊影。此类浑浊影也可能与遗传性表面活性剂异常有关,强调了某些发育性肺疾病(DLD)影像学表现的非特异性。C. 一名4周大的近足月新生儿,由于遗传性表面活性蛋白B(SP-B)缺乏导致呼吸衰竭。胸部CT显示弥漫性磨玻璃样肺部浑浊影,与已知的表面活性剂异常一致。D. 一名4个月大的前26周胎龄早产儿,因严重的支气管肺发育不良(BPD)导致呼吸衰竭和肺动脉高压。胸部CT显示多处囊性高透光肺叶(箭头所指),是BPD中肺泡生长异常的特征性表现。E. 一名7个月大的婴儿,患有与Filamin A相关的肺病,导致进行性呼吸功能不全。胸部CT显示显著的上肺叶过度膨胀和高透光(星号所指),类似于肺气肿,并伴有依赖性下肺叶肺不张(箭头所指),这些是该疾病的特征性表现。F. 一名3个月大足月婴儿的正常胸部CT用于对比。
由于在显示肺实质方面的局限性以及经常需要镇静,MRI通常不用于这一疾病人群。然而,MRI作为儿科DEVLD的影像学工具,尤其是在早产儿肺疾病中,正逐渐成为一个受欢迎的研究领域。使用超极化氙MRI已经显示出通气异常和异质性,表明在支气管肺发育不良(BPD)人群中存在不同的功能表型。当与气体交换MRI技术结合时,MRI可能能够提供有关肺血管疾病(PVD)的功能性细节,这也是CT的当前限制之一。尽管这种方法非常有前景,但目前仍处于研究阶段,尚未广泛应用。
核医学通气/灌注(V/Q)扫描传统上用于评估某些PVD,如肺栓塞、分流和肺灌注差异,但在儿科,特别是婴儿中的应用情况各异。可以考虑将该研究的通气(V)或灌注(Q)部分作为其他影像学手段(如超声心动图或CT)的辅助手段。
影像学检查的挑战包括研究类型和时机的选择,尤其是在需要麻醉才能完成测试的情况下。强烈建议与本地的影像学专家进行深入讨论,以明确:a)具体的研究选择;b)关于放置顺序和研究技术的细节(如是否使用造影剂、研究的定时);c)在研究过程中如何管理孩子的呼吸模式和影像获取的时机;d)是否需要镇静以完成测试,以及如何平衡风险和诊断收益;e)在机构内进行研究的最佳时间,以确保充分的支持和人员配备,从而优化测试结果;f)孩子的转运条件和胸腔结构的可视化。孩子是否已经插管很长时间,从而导致广泛的肺不张?还是存在需要利尿的肺水肿?这些情况都可能遮蔽肺实质的部分区域,从而影响完整的放射学评估,因此,尽量减少这些情况将有助于优化影像学的可视化和放射学评估。
发育性肺疾病(DEVLD)的基因检测
随着应用遗传学的进步,对婴儿发育性肺疾病(DEVLD)的处理方法也在不断发展。在现代医学中,可供选择的基因检测手段种类繁多:包括染色体微阵列分析(CMA)、预先设定的特定基因评估面板、全外显子组测序(WES)和全基因组测序(WGS),这些检测手段在大多数临床中心的机构和商业实验室中均可进行。然而,常见的困惑是:该选择哪种基因检测?保险是否覆盖?选择的检测方法的结果需要多长时间?结果是否足够快,以便我能够采取行动?基因检测是否比肺活检更具信息价值?
对于婴儿期和儿童期发病的儿科DEVLD,基因检测的诊断效果较高,因此强烈建议所有儿科DEVLD患者都进行基因检测。在某些情况下,基因检测可能在肺活检(LBx)、肺移植或尸检的组织病理学数据出现之前或缺乏这些数据的情况下进行,以指导检测选择。通常,基因评估应从候选基因面板的测序开始,例如新生儿肺疾病和/或肺动脉高压面板(见表1),并随着新基因的发现进行修订。检测应包括测序和方法如多重连接依赖性探针扩增(MLPA)、定量聚合酶链反应或基于序列的方法,以评估如TBX4等基因的基因内或整个基因的缺失或重复,因为这些情况较为常见。
作为一种实际考虑,当前的方法包括同时检测DEVLD相关基因和PH相关基因,这通常需要临床医生使用由行业主导的基因检测程序(例如,私营实验室根据美国医学遗传学和基因组学学院(ACMG)临床遗传学实验室技术标准提供的检测)。如果存在综合征性表型特征,还应考虑进行CMA检测。
需要注意的是,大多数来自ACMG标准实验室的基因“面板”实际上使用的是下一代测序(NGS)(例如,外显子组或基因组测序)来进行“面板”检测。对于通过面板检测未发现基因突变的个体,下一步可以直接与进行该检测的ACMG实验室进行对话,了解是否有可用的NGS数据。此外,在进行NGS检测时(无论是使用先前的样本还是发送新的DNA样本进行检测),可能有必要纳入父母DNA的检测,以更好地解读患病患者中的可能的新发突变。在这种情况下,基因检测策略需要在检测成本、保险覆盖范围和结果周转时间之间取得平衡。一旦在家族中识别出致病变异,可以对患病和无症状的家族成员进行针对家族致病变异的靶向检测。
在这一时代,基因检测的一个关键机会和挑战是科学家对基因组中遗传变异贡献的理解以及对基因组进行调查的技术的快速扩展。由于大多数商业“靶向基因面板”是作为WES/WGS分析的一部分进行的,接受这种基因检测的个体将获得更广泛的基因组数据,但并非所有数据都会被分析;检测仅报告面板上的基因。谨记这一点,建议每2-3年与基因检测实验室重新审查现有数据,因为可能存在新发现的基因和/或感兴趣的变异,而这些变异在以前的生物信息学分析中尚未探索。大多数商业实验室提供此类更新分析,可能免费或收取服务费。
值得注意的是,随着NGS与CMA的结合的快速扩展,诊断效率也随之提高。最近,ACMG调整了其建议,指出WES/WGS可以作为多发性先天性异常婴儿或智力障碍或发育迟缓儿童的基因检测的一级或二级方法。这可能对新生儿和婴幼儿病症尤为相关,但尚不清楚这一建议如何适用于DEVLD患儿的护理。鉴于此,目前建议大多数情况下首先进行候选基因面板测序,最好与遗传学专家支持相结合。
遗传咨询
医疗团队应包括熟悉心肺疾病的遗传学家和遗传咨询师,他们了解当地医院/中心关于基因检测的政策和规定。与这些专家合作至关重要,以确保在进行DEVLD检测时,能够向家庭解释检测的风险和收益,因为检测可能会揭示一些临床上未预料到的突变或变异,从而增加新的焦虑和治疗的复杂性。由于信息的复杂性、父母对子女传递的负罪感和其他家庭动态等原因,将基因检测结果传达给家庭成员可能具有挑战性。一旦识别出致病变异,遗传专业人士在教育和指导家庭成员方面发挥着关键作用。
肺活检
肺楔形活检(LBx)是评估发育性肺疾病(DEVLD)的重要诊断工具,尤其在儿童间质性肺病(ILD)的诊断中。然而,不同机构之间的LBx使用频率差异较大。近年来,基因评估和影像学方法的进步引发了新的决策点,通常在以下临床场景中考虑LBx:
-
依赖呼吸机/体外膜肺氧合(ECMO)支持的婴儿
-
未解释的影像学发现
-
临床症状与影像学表现不符
-
标准治疗无效的呼吸症状
-
医疗/手术干预后无法解释的严重肺动脉高压(PH)
-
标准血管扩张治疗无效且伴有肺水肿的PH
这些场景中常见的疑问是:在这些情况下,组织检查的益处是否超过外科活检的风险?LBx的主要益处包括:
-
提供组织学评估以指导药物治疗
-
指导肺移植和生命支持疗法的决策
-
排除临床鉴别诊断(DDx)中可能影响DEVLD患者管理的疾病病因
病理解释的关键要素。成功的病理解释需要两个关键要素:1)包含所有关键解剖结构的LBx标本;2)关键的临床和影像学发现,包括重要的测试结果。
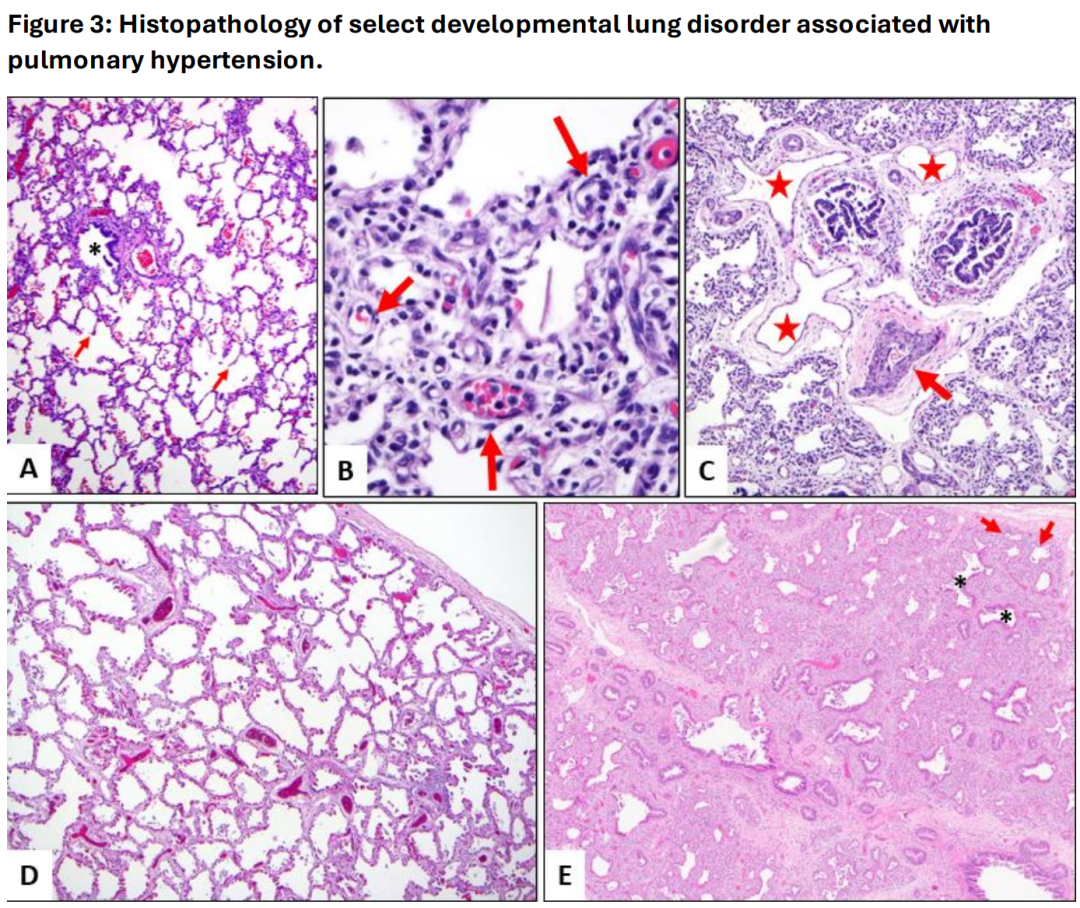
图3:与肺动脉高压相关的选择性发育性肺部疾病的组织病理学。A. 正常的肺部发育显示支气管血管束(星号标记气道)周围有大量肺泡,肺泡隔薄而细腻,并且有适当的二次隔膜(箭头所指)。B. 肺泡毛细血管发育不良伴肺静脉错位(ACD-MPV)。这是典型的肺泡毛细血管发育不良病例,显示宽大的肺泡隔膜,且中央毛细血管稀少(箭头,B图)。C. 肺泡毛细血管发育不良伴肺静脉错位(ACD-MPV)。薄壁静脉通道(星号,C图)紧密关联于支气管血管束,符合肺静脉错位的表现。肺动脉分支显示显著的中膜肥厚(箭头,C图),与肺动脉高压变化一致。D. 与TBX4相关的发育性肺疾病。来自一位TBX2/4突变患者的肺脏标本显示肺泡发育受损,其特征为增大的、简化的气腔,缺乏二次隔膜。肺泡隔膜宽大,并且贯穿有双层毛细血管,伴有轻度间质纤维化(D图)。E. 与TBX4相关的发育性肺疾病。E图展示了先天性腺泡发育不良,其特征为几乎完全缺乏肺泡发育。注意气道剖面(星号)周围有大量间质和少量原始气腔(箭头)。疾病的局部性和有时隐匿的性质强调了适当采样的重要性。
标本处理和沟通
推荐的组织处理方法已经发布,但确保LBx的最佳化以在DDx中区分不同疾病,需要临床服务、外科医生和病理学家之间的沟通。活检的时机可能会影响解释,因为许多患者可能遭受氧气毒性、气压或容积创伤,识别医源性损伤模式是LBx解释的关键方面,某些情况下可能限制诊断的有效性。因此,建议与具有肺病专长的病理学家进行咨询,以提高LBx的诊断效益。
活检样本和技术要求
为了评估气道、肺动脉和肺静脉,首选的组织样本是包含支气管血管束和小叶间隔的足够诊断的楔形活检。尽管经支气管活检提供了气道样本,但它们并不足以完全评估结构异常以进行诊断。为了确保组织被优先用于病理评估和辅助研究,活检前对关键DDx的讨论至关重要。
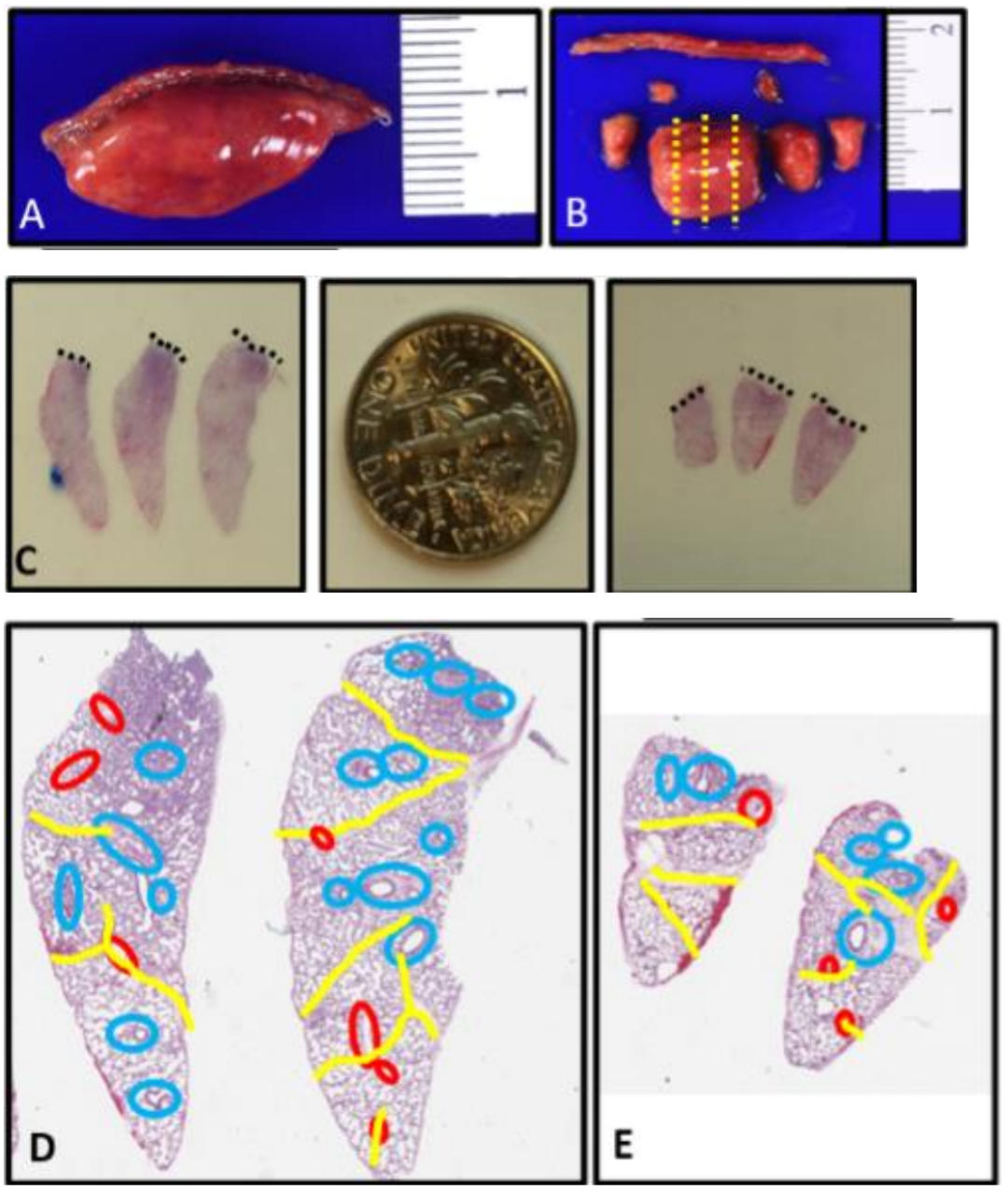
图 4:应进行深楔活检以评估发育性肺疾病。A. 刻度线放置在婴儿的楔形活检样本上,以展示活检深度应至少为1厘米,不包括钉线。B. 在移除钉线(钉线无法进行组织学处理)后,从边缘取出部分组织用于特殊研究,中心部分用福尔马林充气并垂直于钉线切割(黄色虚线表示切割线)。C. 显示了一次深度超过1厘米的合格活检(左侧)和深度小于1厘米的次优活检(右侧)的组织学横截面,用于大小比较(黑色虚线表示钉线)。美国10美分硬币用于大小对比。D和E. 合格活检(D)和次优活检(E)的叠加图显示了不同大小的活检中可供评估的血管数量差异(黄色代表小叶间隔,红色代表静脉,蓝色代表动脉)。较小的活检样本中可评估的支气管血管束较少,并且这些束通常集中在钉线边缘,可能存在挤压伪影。随着儿童的成长,他们在每个支气管血管束之间增加了肺泡的数量,因此较大的儿童需要更大的活检样本以进行充分的结构评估。
临床设置和设施考量
在可能需要高级机械支持(如ECMO)的医疗设施中进行活检,以应对活检后的临床恶化。如果有较高的检测前概率认为LBx将显示可能适合肺移植或需要ECMO支持的疾病,应在进行活检之前与肺移植团队进行沟通,并在必要时启动转院,以避免影响移植候选资格的活检相关并发症。
与基因检测的整合
将基因检测与病理学发现相结合可以提高诊断效益,这两者是互补的,并提供有关疾病病因的重要见解。在靶向基因面板结果为阴性的情况下,病理学发现对于指导进一步的基因检测至关重要,并在识别未知临床意义的变异(VUS)时确认表型变化。对于目前表型结果尚未明确的基因变异,组织检查在解释基因发现的临床意义以及识别新疾病实体、澄清基因型-表型关系和定义遗传疾病严重程度的异质性方面发挥着关键作用。
死后检查
死后检查是一种延伸对患者和家庭的照顾的额外机制。大多数中心为已故患者提供免费尸检服务。系统的全身检查可以诊断疾病,评估生前未明确的多器官疾病表现,更好地定义现有诊断,为家属提供重要信息,以告知和指导家人,并可能有助于患有相同疾病的兄弟姐妹、家庭成员或其他人。
共识要点:DEVLD 的诊断评估
-
胸部 CT 扫描:应使用胸部 CT 扫描来评估肺实质受累情况。如果需要评估肺血管解剖结构,应使用对比剂。
-
基因检测:如果可能,候选基因面板测序应作为诊断 DEVLD 的第一步。如果结果为阴性,可以考虑扩展检测(如全外显子组测序或全基因组测序)或进行肺活检。决策将受实验室限制(如检测的可用性和周转时间)、家庭在咨询后的偏好、患者的稳定性以及人员资源(如手术和病理)的影响。在考虑基因研究时,建议临床团队在检测前和结果返回时与基因咨询团队合作。
-
肺活检的考虑:需考虑临床数据、患者稳定性(包括是否需要 ECMO 支持)以及对长期管理的影响。组织样本的充分性和处理对于经验丰富的病理学家进行适当的审查至关重要。
参考文献:
Varghese NP, Austin ED, Galambos C, Mullen MP, Yung D, Guillerman RP, Vargas SO, Avitabile CM, Chartan CA, Cortes-Santiago N, Ibach M, Jackson EO, Jarrell JA, Keller RL, Krishnan US, Patel KR, Pogoriler J, Whalen EC, Wikenheiser-Brokamp K, Villafranco NM, Abman SH; Pediatric Pulmonary Hypertension Network (PPHNet). An Interdisciplinary Consensus Approach to Pulmonary Hypertension in Developmental Lung Disorders. Eur Respir J. 2024 Aug 15:2400639. doi: 10.1183/13993003.00639-2024. Epub ahead of print. PMID: 39147412.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#肺动脉高压# #诊断评估# #发育性肺疾病#
86