Nat Med: 肿瘤内皮细胞屏障参与肿瘤免疫耐受
2014-06-18 肿瘤新青年论坛 肿瘤新青年论坛
在很多不同的肿瘤中,那些肿瘤微环境中具有高水平T细胞浸润的患者往往具有更好的预后。从实验角度来看,增加免疫杀伤T细胞在肿瘤微环境中的浸润无疑对于抗肿瘤免疫以及肿瘤细胞的清除都是至关重要的。肿瘤在发生发展过程中表现出来的形态以及功能的多样及复杂性必然给征服肿瘤带来了难以逾越的鸿沟。肿瘤复杂的生物学进程其中也包括了血管生成(angiogenesis)以及免疫逃避(immune evasion)。并且我
在很多不同的肿瘤中,那些肿瘤微环境中具有高水平T细胞浸润的患者往往具有更好的预后。从实验角度来看,增加免疫杀伤T细胞在肿瘤微环境中的浸润无疑对于抗肿瘤免疫以及肿瘤细胞的清除都是至关重要的。肿瘤在发生发展过程中表现出来的形态以及功能的多样及复杂性必然给征服肿瘤带来了难以逾越的鸿沟。肿瘤复杂的生物学进程其中也包括了血管生成(angiogenesis)以及免疫逃避(immune evasion)。并且我们发现肿瘤血管生成常常伴随着T细胞介导的肿瘤排斥反应的抑制。研究发现在一些促血管因子的影响下,内皮细胞能够形成抑制T细胞浸润肿瘤微环境的屏障。这里我们可以将这种现象称之为肿瘤内皮屏障(tumor endothelial barrier)。因此,有效的肿瘤免疫治疗必须能够突破这样的屏障。FasL是在生理条件下介导T细胞凋亡的配体,已有报道称其在肿瘤内皮细胞上表达。
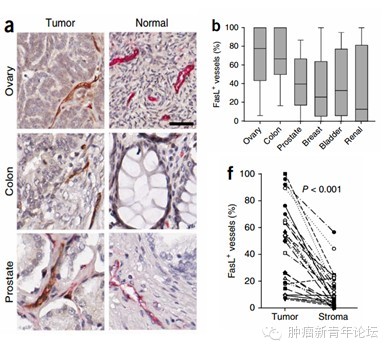
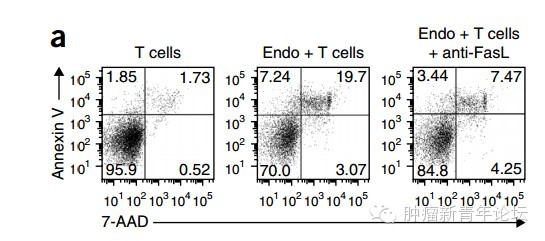
因众所周知FasL是活化T细胞的死亡配体,于是作者进一步检测了肿瘤中新鲜分离的内皮细胞能否杀伤T细胞。结果显示肿瘤内皮细胞能够杀伤肿瘤相关T细胞,并且这种杀伤效应能被FasL阻断抗体所减弱。
接下来作者进一步通过研究,希望明确诱导内皮细胞产生FasL表达的影响因素。研究发现IL-10、PGE2和VEGF-A能诱导肿瘤内皮细胞通过FasL途径杀伤T细胞。确定了诱导内皮细胞产生FasL表达的影响因子,作者进一步深入研究了VEGF-A、COX1及COX2之间的相互表达关系对于FasL表达的影响,并且通过药物抑制VEFG及COX来进一步阐明内皮细胞FasL表达与CD8+T淋巴细胞在肿瘤微环境中浸润之间的相关关系,明确了COX与Vegf阻断剂能够促进抗肿瘤免疫环境的产生,改善肿瘤预后。

【小编寄语】
首先来谈谈这篇文章的思路,本文的思路是基于这样一个现象:肿瘤内皮屏障(tumor endothelial barrier)。那么首先通过明确内皮细胞上高表达的FasL,进一步深入探讨研究了内皮细胞上FasL的表达对于T细胞向肿瘤微环境浸润的影响,解释了为什么内皮屏障对于CD8+和CD4+CD25-T细胞有效,而却与CD4+CD25+(Treg)细胞却没有影响,原因在于Treg能够高表达c-FLIP从而能够抵抗FasL诱导的凋亡效应。接下来作者通过筛选,希望寻找到诱导内皮细胞表达FasL的因子,他们发现了IL-10,PGE2以及VEGF-A。紧接着作者利用乙酰水杨酸(ASA)抑制COX及PGE2,以及VEFA抗体研究了其对于FasL表达以及T细胞浸润的影响,发现应用ASA以及vegf抗体能够很好的改善肿瘤预后。当然,结论主要基于实验室研究,但是我们仍然能够将视野扩展到临床应用:比如ASA的应用究竟能否改善肿瘤患者预后?与免疫治疗联用能够增强免疫治疗疗效?vegf抗体与免疫治疗的联用效果如何?等等。这些都是亟待解决的问题,当然我们不能希冀一篇文章能够改变整个临床肿瘤学的实践,但正是这样一小步一小步的发现,让我们对肿瘤治疗的未来充满的希望。
原始出处:
Motz GT, Santoro SP, Wang LP, Garrabrant T, Lastra RR, Hagemann IS, Lal P, Feldman MD, Benencia F, Coukos G.Tumor endothelium FasL establishes a selective immune barrier promoting tolerance in tumors. Nat Med. 2014 Jun;20(6):607-15
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#Nat#
56
#Med#
60
VEGF与其他药物联合治疗对改善肿瘤患者生存期与预后的研究会有很大空间,期待早日进入临床研究阶段,改善患者预后
164