JAMA子刊:难治性ctDNA RAS/BRAF野生型转移性结直肠癌获益于抗EGFR再挑战治疗
2024-05-20 苏州绘真医学 苏州绘真医学 发表于上海
这些发现提示,在难治性ctDNA RAS/BRAF wt转移性CRC患者中,抗EGFR抑制剂再挑战治疗显示出很有前景的抗肿瘤活性。在亚组分析的局限性内,无肝转移与生存期显著改善相关。

对于难治性循环肿瘤DNA(ctDNA)RAS/BRAF野生型(wt)结直肠癌(CRC)患者,再次使用抗表皮生长因子受体(EGFR)抑制剂是否是一种可选治疗方案?这项非随机对照试验汇总了意大利4项前瞻性、2期试验中114例接受抗EGFR再挑战治疗的ctDNA RAS/BRAF wt转移性CRC患者的个体患者数据。
该治疗策略与肿瘤缩小、疾病控制率高以及有前景的无进展生存期和总生存期相关,且无肝脏受累的患者有显著改善。具体来说,114例RAS/BRAF wt ctDNA mCRC患者(中位年龄[IQR],61[29-88]岁;66名男性[57.9%])接受抗EGFR再挑战作为实验性治疗(48名接受西妥昔单抗+阿维鲁单抗治疗,26名接受曲氟尿苷-替匹嘧啶+帕尼单抗治疗,13名接受伊立替康+西妥昔单抗治疗,27名接受帕尼单抗单药治疗)被纳入本分析。83例(72.8%)既往接受过2线治疗,31例(27.2%)既往接受过3线及以上治疗。ORR为17.5%(20例),DCR为72.3%(82例)。中位PFS为4.0个月(95%CI,3.2-4.7个月),中位OS为13.1个月(95%CI,9.5-16.7个月)。无肝脏受累患者的临床预后较好。无肝转移患者的中位PFS为5.7个月(95%CI,4.8-6.7个月),有肝转移患者的中位PFS为3.6个月(95%CI,3.3-3.9个月)(风险比,0.56;95%CI,0.37-0.83;p= .004)。无肝转移患者的中位OS为17.7个月(95%CI,13-22.4个月),有肝转移患者的中位OS为11.5个月(95%CI,9.3-13.9个月)(风险比,0.63;95%CI,0.41-0.97;p=0.04)。治疗显示出可控的毒性作用。
这些发现提示,在难治性ctDNA RAS/BRAF wt转移性CRC患者中,抗EGFR抑制剂再挑战治疗显示出很有前景的抗肿瘤活性。在亚组分析的局限性内,无肝转移与生存期显著改善相关。
研究背景
抗EGFR单克隆抗体(mab)联合化疗是RAS/BRAF wt转移性结直肠癌(mCRC)患者的标准一线治疗。尽管其初始抗肿瘤活性具有较高的总缓解率(ORR),但由于癌细胞获得性耐药,疾病几乎不可避免地发生进展。
众所周知,最常见的耐药变异与EGFR信号级联相关,如EGFR胞外结构域(ECD)或KRAS/NRAS和BRAF等下游效应子的变异。然而,分子变异谱可能随着时间的推移而变化,这取决于所接受的治疗。通过循环肿瘤DNA(ctDNA)的连续液体活检,已经表明RAS/BRAF/EGFR ECD变异的癌细胞克隆的半衰期约为4个月。因此,疾病进展后,在所谓的抗EGFR治疗假期期间,耐药克隆可能会衰减,从而可能恢复对EGFR阻断剂的敏感性。因此,在过去10年中,不同的研究小组研究了抗EGFR再激发治疗在难治性RAS wt mCRC患者中的作用。在这些试验中,选择患者的主要临床标准是接受抗EGFR治疗,临床获益后出现疾病进展,然后接受后续无抗EGFR治疗。在未经选择的难治性疾病患者人群中,化疗联合抗EGFR再挑战治疗与异质性缓解相关,ORR范围为0%-54%。
对这些研究进行的转化性回顾性分析表明,携带RAS/BRAFwt ctDNA的患者从该治疗中获得的临床获益最高。到目前为止,在CHRONOS(由RAS动态耐药驱动的帕尼单抗再挑战)试验中,RAS/BRAF wt mCRC患者接受了帕尼单抗再挑战,这是唯一一项前瞻性地使用液体活检进行患者选择的研究。
尽管有强有力的理论基础,但关于抗EGFR再激发疗法在ctDNA RAS/BRAF wt肿瘤中发挥作用的现有证据质量较差,因为这些证据主要是来自对有限患者数量进行的事后分析。因此,在解释这些结果时需要谨慎,并需要进一步验证。此外,在分子选择的人群中,识别其他可能与临床活动相关的变量是一项未满足的需求。
为了填补这一空白,研究者对来自4项前瞻性2期试验的个体患者数据(IPD)进行了汇总分析。本试验仅纳入基线时经液体活检证实为ctDNA RAS/BRAF wt肿瘤的患者。最后,研究者进行了探索性亚组分析,以识别更多潜在的生物标志物。
研究方法
在这项非随机对照试验中,研究者对来自4项多中心2期研究的IPD进行了汇总分析:CRICKET研究是一项单组2期试验,在RAS/BRAF wt mCRC患者中研究了西妥昔单抗联合伊立替康作为三线治疗的再挑战。该研究首次提供了再激发疗法治疗难治性mCRC的前瞻性证据。事后分析表明,经证实的缓解仅在液体活检分析未检出耐药变异的患者中观察到;CAVE试验是一项单组、多中心、2期研究,在既往接受过大量治疗的RAS wt mCRC患者中评估了西妥昔单抗联合抗程序性细胞死亡配体1单克隆抗体阿维鲁单抗的再挑战。该研究达到了主要终点,与历史对照相比,生存期延长了3个月以上;CHRONOS研究是第一项根据液体活检结果前瞻性选择适合帕尼单抗再激发治疗的患者的试验,液体活检采用高灵敏度的数字微滴聚合酶链反应(ddPCR)检测血浆中的RAS/BRAF/EGFR ECD变化。试验结果为阳性,ORR为30%;VELO试验是一项随机2期研究,比较了帕尼单抗联合曲氟尿苷-替匹嘧啶再激发与曲氟尿苷-替匹嘧啶作为RAS wt mCRC三线治疗的疗效。该试验达到了主要终点,证明与标准治疗相比,试验组的无进展生存期(PFS)显著延长。本研究纳入了接受EGFR抑制剂再激发治疗,并且基线时表现为RAS/BRAF wt ctDNA肿瘤的患者。患者选择的过程显示在图1。
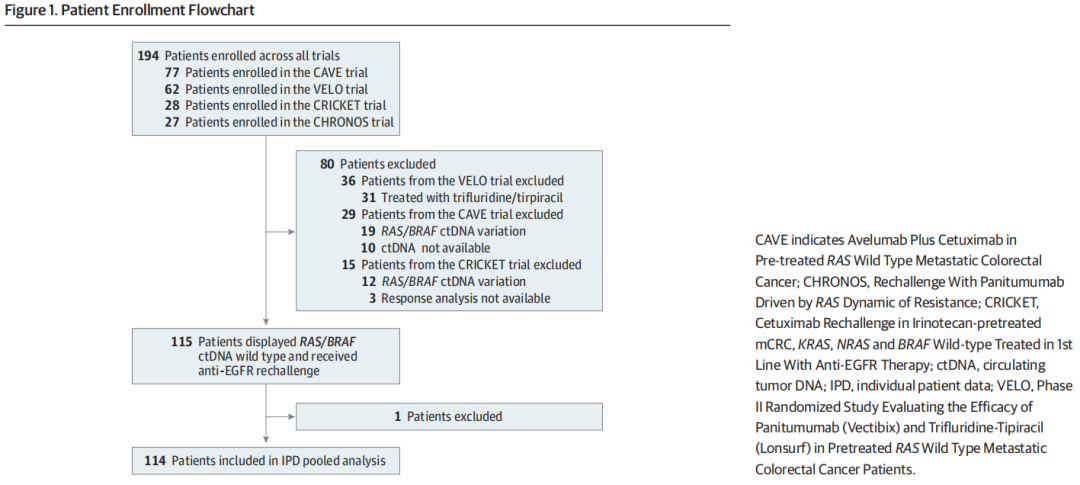
图1
研究结果
患者特征:
总体而言,114例患者(中位年龄[IQR],61[29-88]岁;66名男性[57.9%])符合规定标准并被纳入汇总数据集:CRICKET试验中的13例患者接受了伊立替康+西妥昔单抗治疗,CAVE试验中的48例患者接受了西妥昔单抗+阿维鲁单抗治疗,CHRONOS试验中的27例患者接受了帕尼单抗单药治疗,VELO试验中的26例患者接受了曲氟尿苷-替匹嘧啶+帕尼单抗治疗。研究人群的基线临床特征见表1。83例(72.8%)既往接受过2线治疗,31例(27.2%)既往接受过3线或以上治疗。共36例(31.6%)患者存在≥3个不同的转移部位。最常见的转移部位为肝脏(72例[63.2%]),其次为肺(63例[55.3%])、淋巴结(47例[41.2%])和腹膜(26例[22.8%])。76例患者(66.7%)报告癌胚抗原水平升高(>5 ng/mL;换算为微克每升,乘以1.0)。研究人群既往抗EGFR治疗类型均衡,57例(50.0%)接受西妥昔单抗治疗,56例(49.0%)接受帕尼单抗治疗,1例(0.9%)接受两种药物治疗。
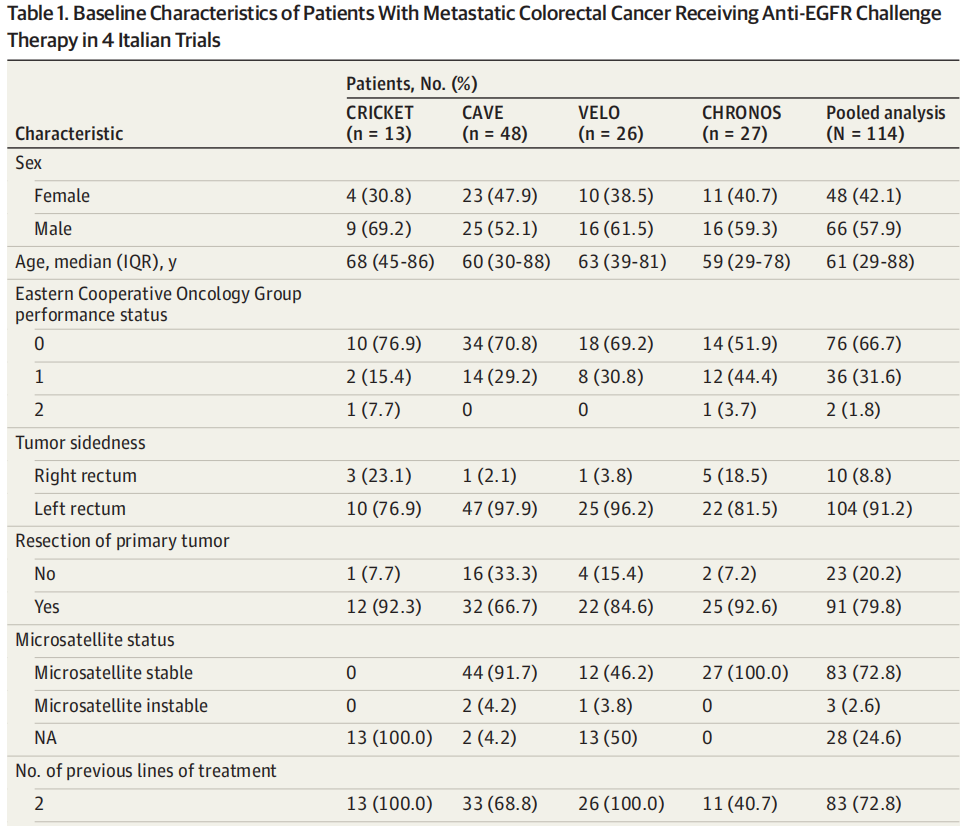
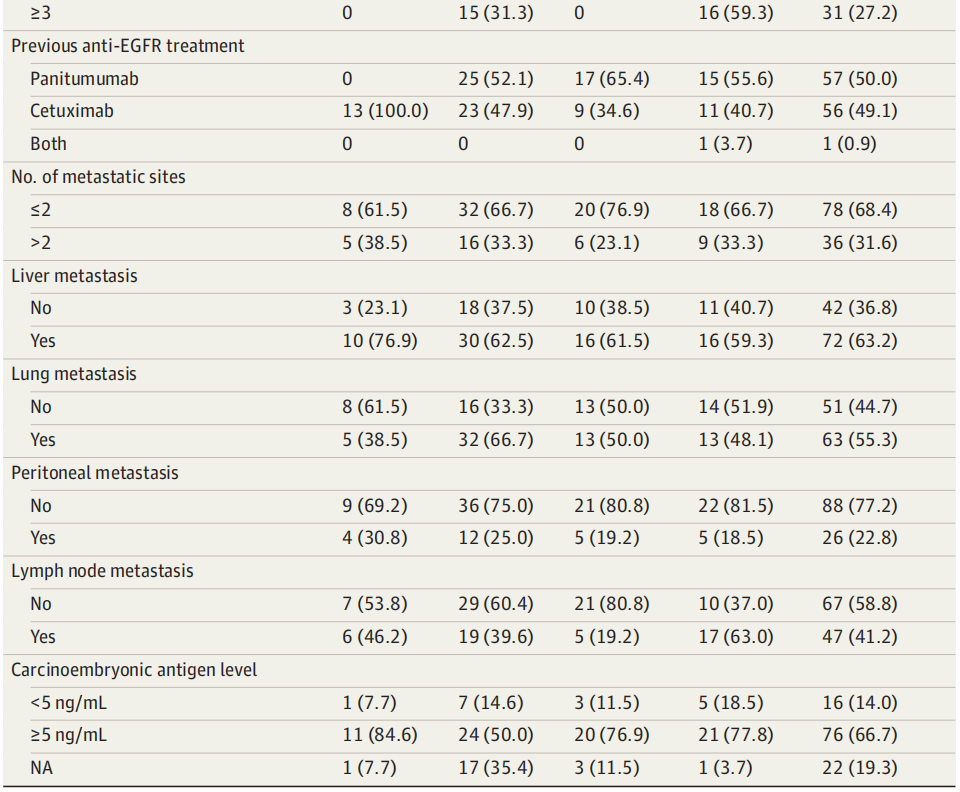
表1
疗效和安全性分析:
中位(IQR)随访时间28.1(25.8-35.0)个月。合并人群的ORR为17.5%(20例患者),其中1例患者达到完全缓解,19例患者达到部分缓解(表2)。65例患者(57.0%)达到疾病稳定。DCR为72.3%(82例)。总体研究人群的中位PFS为4.0个月(95%CI,3.2-4.7个月),中位OS为13.1个月(95%CI,9.5-16.7个月)(图2)。值得注意的是,一部分患者在抗EGFR再激发治疗后疾病得到了长期控制,6个月PFS率为32.5%,18个月OS率为36.0%。
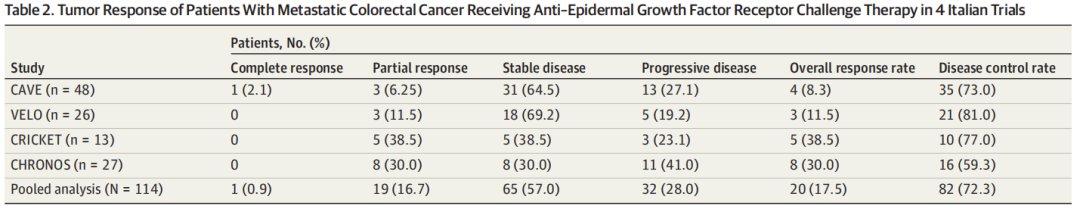
表2
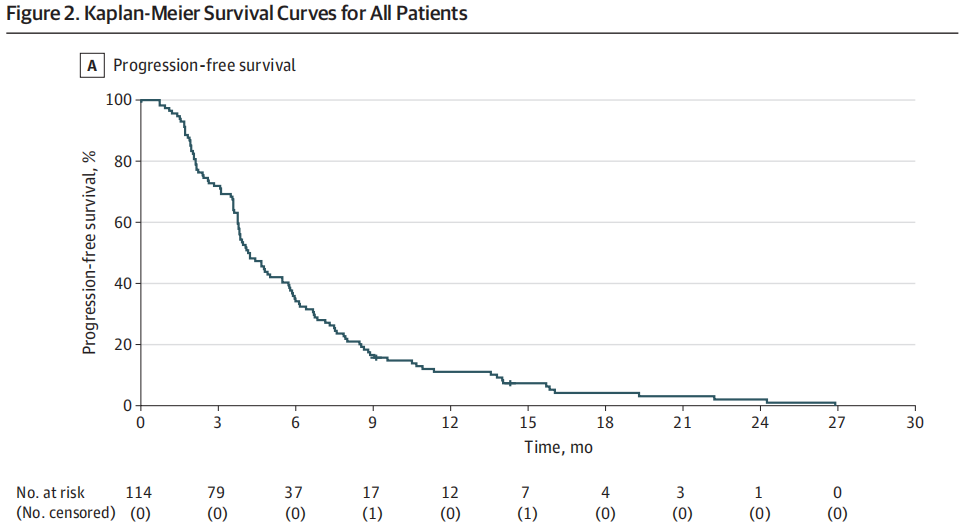
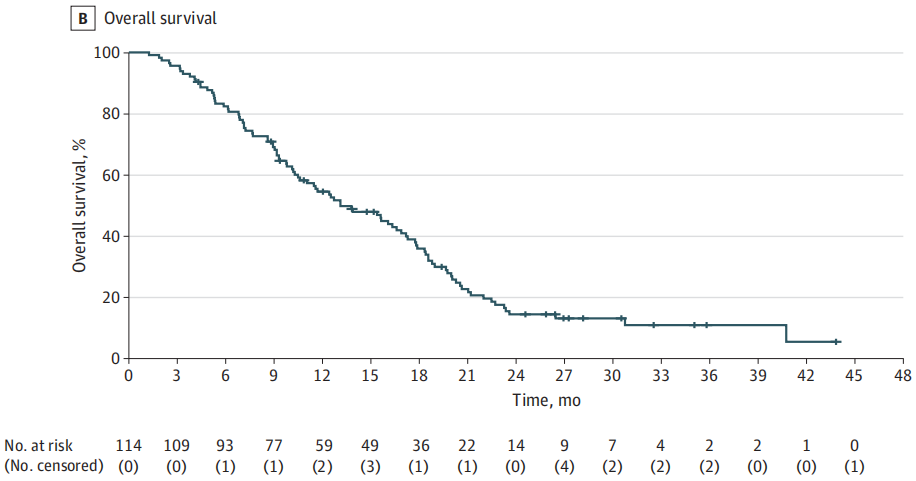
图2
随后,研究者进行了一项探索性亚组分析,以评估几个临床变量(包括体能状态、既往治疗线数、肿瘤负荷、原发肿瘤切除、原发肿瘤侧面、转移部位和癌胚抗原)与治疗结局之间的关联。无肝转移是与PFS和OS改善相关的唯一变量。无肝转移患者亚组的中位PFS为5.7个月(95%CI,4.8-6.7个月),有肝转移患者亚组的中位PFS为3.6个月(95%CI,3.3-3.9个月)(HR,0.56;95%CI,0.37-0.83;P= .004)(图3A)。无肝转移患者的中位OS为17.7个月(95%CI,13-22.4个月),有肝转移患者的中位OS为11.5个月(95%CI,9.3-13.9个月)(HR,0.63;95%CI,0.41-0.97;P= .04)(图3B)。最后,在无肝脏受累的患者中,12个月的PFS率为21.0%,而30个月的OS率为21.6%。
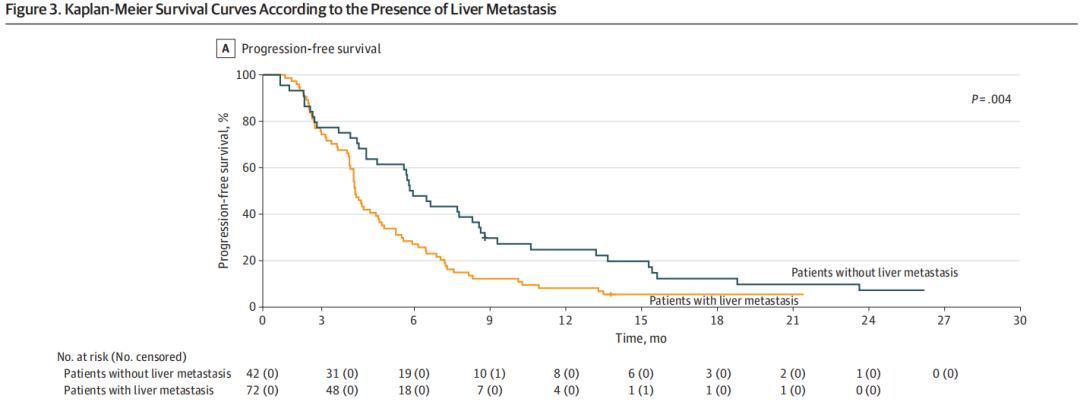
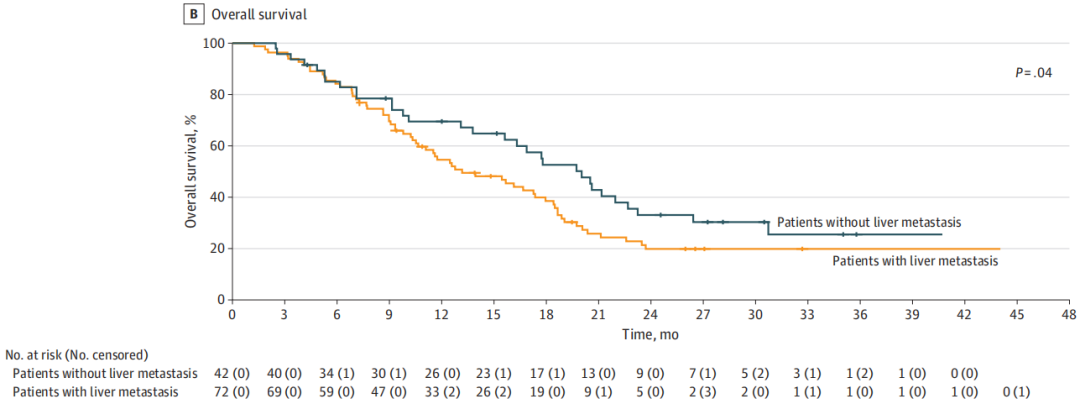
图3
4项临床试验的汇总分析结果与之前的研究结果一致,安全性可控。皮疹(3-4级,24例患者[21%])和腹泻(3-4级,9例患者[8%])是与使用抗EGFR mAb相关的最常见不良事件。19例患者(17%)发生了3-4级中性粒细胞减少,仅发生于接受骨干化疗的39例患者。
讨 论
在过去20年中,对疾病分子因素的发现和更有效治疗方法的临床开发使mCRC患者的治疗有了实质性改善。现在,在一线和二线治疗进展后,超过一半的患者保持良好的体能状态,并愿意接受进一步治疗。
在mCRC的连续治疗中,甚至在后线治疗中,以氟嘧啶为基础的疗法和阻断血管生成是主要的治疗选择。与安慰剂相比,抗血管生成药物瑞戈非尼和呋喹替尼或化疗药物曲氟尿苷-替吡嘧啶有适度但显著的临床获益。迄今为止,SUNLIGHT是唯一一项证明在化疗难治性mCRC患者中,通过积极治疗可改善PFS和OS的随机3期试验。
在这种情况下,我们需要新的、更有效的治疗方案。为了满足这一未满足的需求,在这项非随机对照试验中,研究者对纳入意大利4项前瞻性2期研究的患者的IPD进行了汇总分析,这些研究探讨了不同的抗EGFR再激发策略。由于基线液体活检时RAS/BRAF变异的存在与抗EGFR单抗无应答相关,因此本分析仅纳入了血浆ctDNA RAS/BRAF wt mCRC患者。研究者在此提供了基于现有最大数据集的证据,证明抗EGFR再激发疗法具有抗肿瘤活性。
接受曲氟尿苷-替吡嘧啶、瑞戈非尼或呋喹替尼单药治疗的难治性mCRC患者的预期生存期约为7-9个月,而接受曲氟尿苷-替吡嘧啶+贝伐珠单抗三线治疗的患者的中位OS为10.8个月。此外,可供选择的药物主要显示出细胞抑制活性(ORR,1%-6%)。由于间接交叉试验比较的所有局限性,在本研究中,研究者报告的OS超过12个月,约1/3的患者生存期较长(约18个月)。
在研究人群中,抗EGFR再激发治疗作为三线或更晚的治疗。值得注意的是,根据既往治疗线数不同,未观察到患者的生存期有差异。此外,在这一既往接受过大量治疗的人群中,抗EGFR再激发治疗达到了17.5%的ORR和72.3%的DCR。因此,在潜在的真实临床场景中,EGFR抑制剂的ctDNA相关再激发治疗,可以考虑在曲氟尿苷-替吡嘧啶联合贝伐珠单抗治疗进展后使用,或者在需要肿瘤缩小的情况下,作为三线治疗方案的一个选择。关于难治性mCRC连续治疗中抗EGFR再激发治疗的最佳时机,目前正在进行的PARERE试验的结果将提供进一步证据。总体而言,200多例ctDNA RAS/BRAF野生型肿瘤患者将被随机分组,一组接受帕尼单抗作为三线治疗,随后在疾病进展时接受瑞戈非尼治疗,另一组顺序相反。
为了更好地阐明每种治疗疗效中涉及的潜在因素的作用,研究者进行了一项探索性分析。无肝转移与显著较长的中位PFS和OS相关。值得注意的是,5例患者中有1例在12个月时仍无进展,并且生存超过30个月。当然,由于亚组分析的性质,这些数据需要更大规模的前瞻性试验进一步证实。如果得到证实,需要前瞻性的转化研究和所谓的多组学研究(即使用来自不同研究领域的数据类型的研究,如基因组学、表观基因组学、转录组学、蛋白质组学和代谢组学)来识别对抗EGFR治疗有效的肝转移患者亚群。
局限性
本研究在设计上有几个固有的局限性。首先,这项汇总分析纳入了4项2期研究纳入的患者,这些患者接受了可能影响临床结局的不同治疗。在这方面,目前尚无关于最佳抗EGFR再激发方案的证据。为了解决这一问题,研究团队目前正在开展CAVE-2试验,这是一项随机2期试验,在难治性血浆ctDNA RAS/BRAF野生型微卫星稳定型mCRC患者中,比较了西妥昔单抗+阿维鲁单抗再激发与西妥昔单抗单药治疗。其次,4项试验使用了具有不同灵敏度阈值和不同panel的不同液体活检检测方法进行ctDNA分析。在CHRONOS试验中,使用了高灵敏度的ddPCR,并且仅纳入ctDNA中RAS/BRAF/EGFR ECD变异为0的患者。对于CAVE和VELO试验,使用了IdyllaTM Biocartis平台。然而,非常低的变异丰度对抗EGFR药物应答的真正影响仍有争议。第三,RAS/BRAF以外的其他变异(如EGFR ECD、MAP2K1和ERBB2变异或扩增)可能构成癌细胞对EGFR阻断剂耐药的机制。在未来的试验中,使用更大的二代测序panel选择患者将有助于回答这个问题。第四,由于CRICKET、CAVE和CHRONOS试验的单组设计,以及VELO研究纳入的对照组患者数量减少,因此无法与其他治疗方案进行直接比较。第五,研究者无法评估肝病负荷(肝转移灶的数量和范围)对疗效的影响。这些结果应该被认为是探索性的和产生推测的。
在对来自4项2期试验的IPD进行的汇总分析中,抗EGFR再激发疗法在经液体活检证实的难治性RAS/BRAF野生型肿瘤患者中显示出有前景的抗肿瘤活性。在亚组分析的局限性内,无肝转移与生存期显著改善相关。目前正在进行进一步的随机研究来证实这些结果。
参考文献:
Ciardiello D, Martinelli E, Troiani T, et al. Anti-EGFR Rechallenge in Patients With Refractory ctDNA RAS/BRAF wt Metastatic Colorectal Cancer: A Nonrandomized Controlled Trial. JAMA Netw Open. 2024;7(4):e245635. Published 2024 Apr 1. doi:10.1001/jamanetworkopen.2024.5635

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言

















#结直肠癌# #EGFR#
70