JNNP:血浆炎症预测常染色体显性遗传额颞叶变性的表型转化和临床进展
2023-04-26 网络 网络 发表于江苏省
炎症是神经退行性疾病发病机制的核心组成部分。基于血液的生物标志物提供了易于获得、相对非侵入性和可扩展的全身炎症测量。评估无症状和轻度症状疾病阶段的全身炎症生物标志物可能有助于改善预后,并进一步表征外周
炎症是神经退行性疾病发病机制的核心组成部分。基于血液的生物标志物提供了易于获得、相对非侵入性和可扩展的全身炎症测量。评估无症状和轻度症状疾病阶段的全身炎症生物标志物可能有助于改善预后,并进一步表征外周免疫激活在神经退行性疾病中的作用。具有导致额颞叶变性(FTLD)的常染色体显性致病性变异的个体代表了研究全身炎症生物标志物是否具有临床实用性的独特模型。FTLD是65岁以下成年人痴呆最常见的原因之一。高达40%的FTLD病例有痴呆家族史,约10%有常染色体显性遗传。大多数已确定的遗传性FTLD病例是由三个基因之一的致病性变体引起的:9号染色体开放阅读框72(C9orf72)、前颗粒蛋白(GRN),或微管相关蛋白tau(MAPT)。体内和体外模型表明,中枢和全身炎症途径都可能影响FTLD神经退行性变的严重程度。在具有致病性GRN变体的FTLD患者中,免疫功能的血液生物标志物与临床严重程度和脑结构相关,尤其是白质。此外,与健康对照组和阿尔茨海默病患者相比,系统性自身免疫性疾病在FTLD患者中的发病率不成比例。很少有临床研究评估外周炎症对人类FTLD疾病进展的作用。量化反映炎症状态的关键标志物可能有助于确定治疗的靶向途径,并为血浆炎症生物标志物在帮助疾病转化和预后方面的应用提供信息。
最近的研究集中在对FTLD神经元变性敏感的生物标志物上。越来越多的证据支持血浆神经丝轻链(NfL)作为FTLD诊断、预后和治疗的候选生物标志物,和治疗反应测量。尚未对家族性FTLD患者的血浆炎症标志物进行研究,这些患者从无症状到有症状的疾病阶段进行纵向随访。确定与症状转换和有临床意义的FTLD结果(如日常功能、行为、认知可能支持使用全身炎症测量以及神经元和神经胶质功能障碍的标志物。评估了三种在炎症途径中具有广泛影响作用的蛋白质——IL-6、YKL-40、TNFα——在从常染色体显性遗传性FTLD致病性变异携带者和对照(非携带者家族成员)收集的血浆中,在ARTFL-LEFFTDS纵向额颞叶变性(ALLFTD)联合体内进行了纵向随访。我们研究了(A)遗传组(MAPT、C9orf72、GRN)之间的血浆炎症水平,(B)基线血浆炎症水平是否与临床功能和脑容量的变化率有关,(C)炎症标志物区分稳定的无症状参与者和表型转化为有症状疾病的参与者的能力,以及(D)将血浆炎症水平与血浆NfL配对以识别无症状转化者的额外预后价值.本研究发表在《神经病学,神经外科学和精神病学杂志》上()

测量了致病性变异携带者(MAPT、C9orf72、GRN)和参加ARTFL-LEFFTDS额颞叶纵向退化联合会的非携带者家族成员的IL-6、TNFα和YKL-40的血浆浓度。评估了基线血浆炎症与临床和神经影像学变化率之间的相关性(具有标准化(z)结果的线性混合效应模型)。使用曲线下面积分析比较了临床正常的无症状携带者(“有症状的非转化者”)和有症状的携带者(“症状的转化者””)之间的炎症。将辨别准确度与血浆神经丝轻链(NfL)的辨别准确度进行比较。
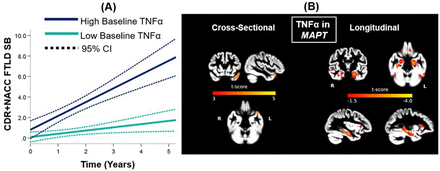
致病性MAPT变异携带者基线血浆TNFα与疾病严重程度变化率的相关性
研究了394名参与者(非携带者=143,C9orf72=117,GRN=62,MAPT=72)。在MAPT中,较高的TNFα与更快的功能下降(B=0.12(0.02,0.22),p=0.02)和颞叶萎缩有关。在C9orf72中,较高的TNFα与更快的功能下降(B=0.09(0.03,0.16),p=0.006)和认知能力下降(B=−0.16(−0.22,−0.10),p<0.001)有关,而较高的IL-6与更快的功能下降有关(B=0.12(0.03,0.21),p=0.01)。无症状转化者的TNFα高于非转化者(β=0.29(0.09,0.48),p=0.004),并且与单独的血浆NfL相比提高了辨别能力(ΔR2=0.16,p=0.007;NfL:OR=1.4(1.03,1.9),p=0.03;肿瘤坏死因子α:OR=7.7(1.7,31.7),p=0.007)。

血浆TNFα对血浆NfL的附加值,用于区分无症状转化者和无症状非转化者
评估了ALLFTD联合体中FTLD致病性变异携带者的血浆TNFα、IL-6和YKL-40水平。最一致的发现与血浆TNFα有关,TNFα是一种促炎细胞因子。在MAPT和C9orf72携带者中,较高的基线血浆TNFα与较快的临床进展有关,包括C9orf七十二携带者的执行功能下降。在MAPT组中,较高的基线TNFα也与基线时较低的颞叶下叶和内侧叶体积以及广泛分布区域的更快的纵向萎缩率有关。基线炎症和脑萎缩之间的相关性反映了先前报道的不同基因变体的区域体积损失和萎缩率模式。在基线时,MAPT组中,较高的基线TNFα与较低的颞叶体积以及广泛的皮质区域纵向萎缩速率之间的相关性最强。在无症状和前驱疾病阶段,MAPT致病性变异携带者最初在颞叶加速了体积损失,随后随着症状的进展而在全球范围内传播。基于血液的炎症蛋白水平并不能单独或完全反映大脑中的神经炎症。外周中枢免疫反应可能会产生双向影响。小胶质细胞通过沿着从监测的吞噬状态到激活的吞噬状态的表型谱发挥作用来调节大脑的免疫反应,促炎状态。动物模型显示,外周炎症可通过单核细胞渗透血脑屏障导致小胶质细胞活化。活化的小胶质细胞也会募集外周单核细胞,以应对脑损伤或疾病。
系统性炎症蛋白测量可以改善常染色体显性遗传FTLD致病性变异携带者的临床预后,这些携带者尚未表现出严重损伤。较高的基线全身炎症,特别是TNFα,可能与疾病进展较快有关。将TNFα与NfL等神经元功能障碍标志物整合,可以优化对无症状致病性变异携带者即将发生的症状转换的检测。外周免疫系统作为一种可靶向且易于测量的生物途径,值得继续研究。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言