Science Immunology:细胞自噬的黑暗面,帮助癌细胞逃脱免疫系统杀伤
2020-12-31 生物世界 Bio生物世界
肿瘤免疫治疗的兴起,为人类彻底攻克“万病之王”——癌症带来了新的曙光。其中,免疫检查点阻断疗法已成为当今最热门的免疫疗法之一。
肿瘤免疫治疗的兴起,为人类彻底攻克“万病之王”——癌症带来了新的曙光。其中,免疫检查点阻断疗法已成为当今最热门的免疫疗法之一,该疗法显著改变了目前癌症治疗的格局,而PD-1/PD-L1免疫阻断疗法正是最典型的代表。
虽然肿瘤免疫疗法显著改变了癌症治疗格局,但由于多种原因,仍有很大一部分患者对这些疗法没有反应。因此,我们还需要进一步深入了解肿瘤细胞对T细胞杀伤敏感性的分子机制。
自噬(Autophagy)是一种进化上非常保守的溶酶体介导的生物降解过程,是对细胞自身废物的回收再利用,对细胞内稳态具有重要的调控作用,因此,细胞自噬与多种疾病有密切关系。
近日,再生元公司科学家在 Science 子刊 Science Immunology 杂志发表了题为:Autophagy protects tumors from T cell–mediated cytotoxicity via inhibition of TNFα-induced apoptosis 的研究论文。
该研究发现,细胞自噬也存在黑暗的一面:帮助肿瘤细胞逃脱免疫系统攻击。
再生元的研究人员使用CRISPR筛选技术,发现敲除一个名为Rb1cc1的自噬相关基因,可以增加肿瘤细胞对T细胞的杀伤敏感性,从而增强PD-1和CTLA-4检查点抑制剂的抗癌效果。
这些发现提示了自噬在癌症中的新作用,为使用自噬抑制剂提高肿瘤免疫疗法在更多患者中的效果开辟了新方向。
为了确定调控肿瘤细胞对T细胞介导的杀伤敏感性的基因,研究团队在小鼠结肠腺癌细胞中进行了全基因组CRISPR/Cas9筛选。
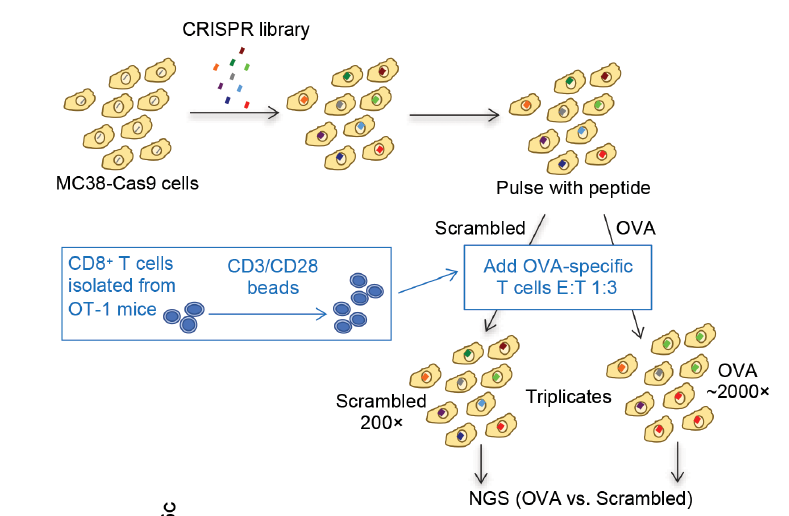
试验结果表明,炎症分子TNF-α在肿瘤细胞死亡中起关键作用,这一发现与以前的研究一致。相比之下,肿瘤细胞中的自噬似乎可以保护它们免受T细胞介导的死亡。
研究团队敲除(KO)了三个关键的自噬基因——Rb1cc1、Atg9a和Atg12,能够显著增加肿瘤细胞对T细胞的杀伤敏感性。
研究团队进一步发现,用抗体阻断TNF-α的同时敲除(KO)Rb1cc1基因,对杀伤肿瘤细胞的作用非常有限,这表明自噬对肿瘤细胞的保护作用主要是通过TNF-α通路介导的。
研究团队进一步在乳腺癌小鼠模型中测试了这一发现,同样的,敲除(KO)Rb1cc1基因,能够增加对乳腺癌细胞的杀伤力。
研究团队用PD-1抗体和CTLA-4抗体的组合,对乳腺癌小鼠模型进行了治疗,结果表明该组合抗体完全清除了敲除Rb1cc1基因的肿瘤细胞,却只能适度抑制对照肿瘤细胞的生长。在结肠癌模型中也观察到类似的结果。
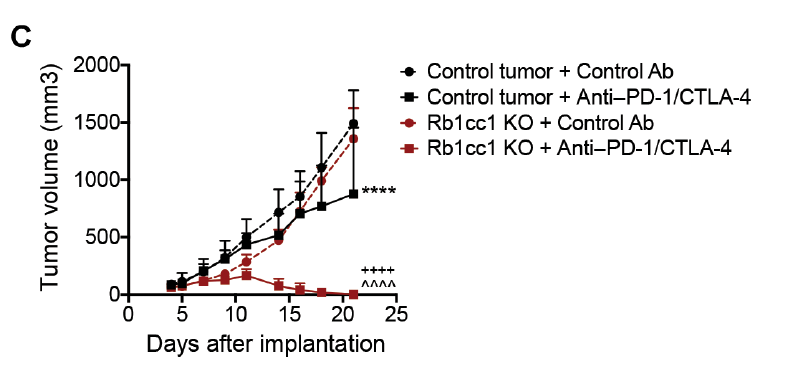
研究数据还表明,即使在敲除(KO)了Rb1cc1基因的肿瘤细胞中中,同时敲除TNF-α受体也限制了免疫疗法的抗癌作用,这表明TNF-α和自噬对于T细胞杀伤肿瘤细胞确实是必不可少的。
除了再生元公司,也有其他研究团队发现自噬在癌症免疫治疗中的作用。
2020年9月23日,加拿大多伦多大学 Jason Moffat 团队在 Nature 杂志题为:Functional genomic landscape of cancer-intrinsic evasion of killing by T cells 的研究论文。
研究团队通过CRISPR筛选,在乳腺癌、结直肠癌、肾癌和黑色素瘤的6种小鼠肿瘤细胞中进行筛选,成功鉴定了182个“核心癌症固有免疫逃逸基因”,这些基因的缺失使癌细胞对T细胞攻击更加敏感或更具有抵抗力。这项研究成功绘制了癌症免疫逃逸基因图谱。
该研究发现,同时敲除自噬相关基因Atg12和Atg5,有助于肿瘤细胞抵抗T细胞杀伤,而仅敲除其中之一则没有这种效果。详情:Nature:这182个基因,帮助癌细胞逃脱免疫系统追杀
总体而言,再生元公司的这项研究表明,靶向细胞自噬通路可能是增强T细胞免疫疗法对肿瘤杀伤能力的有前途的策略,有望帮助更多癌症患者受益于强大的癌症免疫治疗药物。
原始出处:
Tara M. Young*, Claudia Reyes, Elizabeth Pasnikowski, et al. Autophagy protects tumors from T cell–mediated cytotoxicity via inhibition of TNFα-induced apoptosis.Science Immunology. 18 Dec 2020:Vol. 5, Issue 54, eabb9561DOI: 10.1126/sciimmunol.abb9561
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言










学习了
154
#癌细胞#
86
#细胞自噬#
85
#SCIE#
117