一次注射长期有效,诺奖团队第二款体内CRISPR疗法临床数据给力
2022-09-19 王聪 “生物世界”公众号
AATR 是一种危及生命的严重罕见遗传疾病,据估计,全球大约有5万名患者,该疾病的特征是错误折叠的转甲状腺素蛋白(TTR)蛋白神经和心脏等组织中积累。
2022年9月16日,Intellia Therapeutics 宣布其第二款体内 CRISPR 基因编辑疗法——NTLA-2002,在治疗遗传性血管水肿(HAE)的1/2期临床试验的中期数据积极。
Intellia Therapeutics 由 CRISPR 基因编辑技术奠基人、诺奖得主詹妮弗·杜德娜(Jennifer Doudna)创立的基因编辑治疗公司,目前市值约50亿美元。
NTLA-2001
2021年6月26日,Intellia Therapeutics 在国际顶尖医学期刊《新英格兰医学杂志》(NEJM)发表了首个体内 CRISPR 基因编辑疗法的临床试验结果,这大大扩展了 CRISPR 基因编辑疗法的应用范围,直接注射 CRISPR 组份即可在体内进行高效基因编辑,为许多遗传疾病的治疗开辟了新的途径,被誉为“开启了医学新时代”。
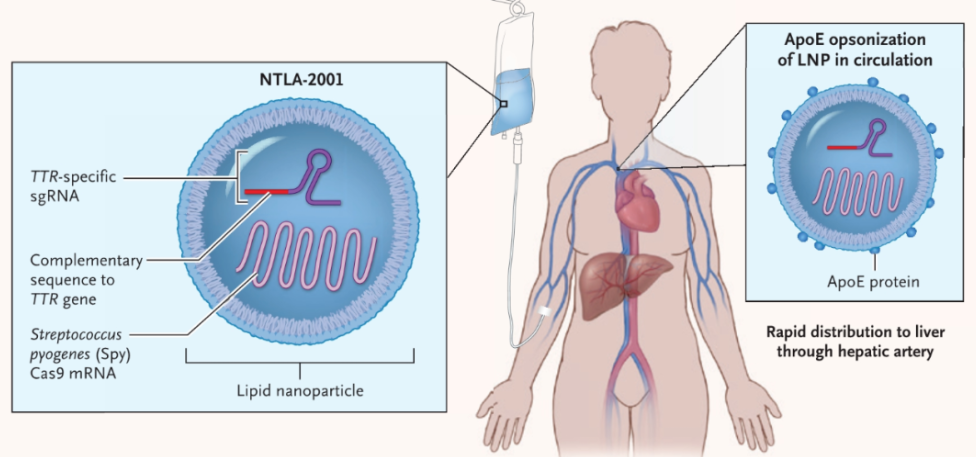
这项名为 NTLA-2001 的疗法,是通过脂质纳米颗粒(LNP)载体,将携带靶向致病基因 TTR 基因的 sgRNA 和优化的 spCas9 蛋白的 mRNA 序列,递送至肝脏。用于治疗转甲状腺素蛋白淀粉样变性(ATTR)。AATR 是一种危及生命的严重罕见遗传疾病,据估计,全球大约有5万名患者,该疾病的特征是错误折叠的转甲状腺素蛋白(TTR)蛋白神经和心脏等组织中积累。
2022年6月24日,Intellia 公布了 NTLA-2001 疗法的最新1期临床试验中期数据,效果积极,单次给药后患者血清中 TTR 蛋白水平的下降幅度在长达12个月时间里能够稳定持续。
主要结果如下:
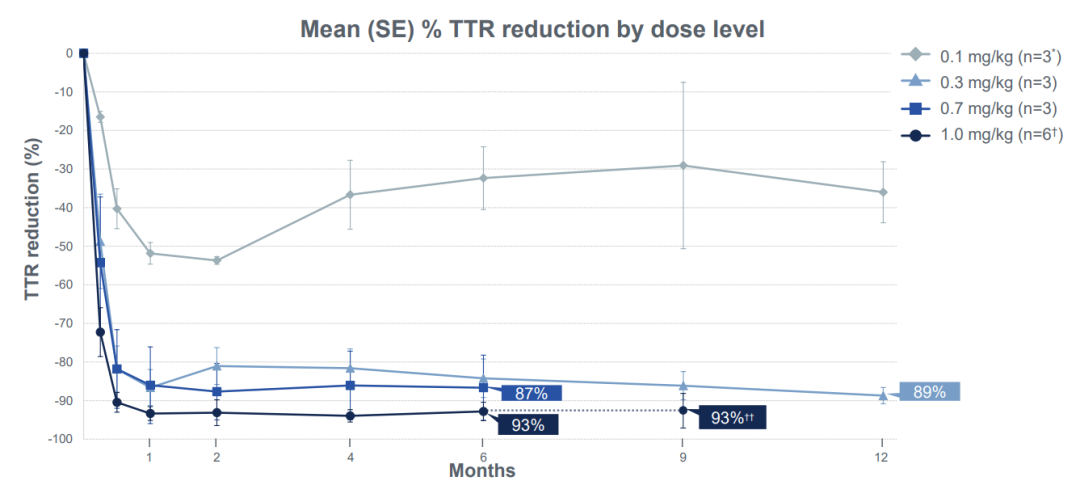
1、患者血清中 TTR 蛋白水平的降低在4组不同给药剂量组中均持续保持,低剂量组(0.1mg/kg和0.3mg/kg组)的随访时间达到了12个月,高剂量组(0.7mg/kg和1.0mg/kg组)的随访期达到了6个月。
2、1.0mg/kg剂量组,给药治疗后第28天血清 TTR 蛋白水平平均降低93%,最高降低98%,效果在随访的6-9个月时间里得以保持。
此次报告的是针对15名患有遗传性转甲状腺素蛋白淀粉样变性伴多发性神经病变(ATTRv-PN)的患者的扩展随访数据,这些患者在第一部分试验中分为四个剂量组:0.1mg/kg组(3人)、0.3mg/kg组(3人)、0.7mg/kg组(3人)、01.0mg/kg组(6人)。
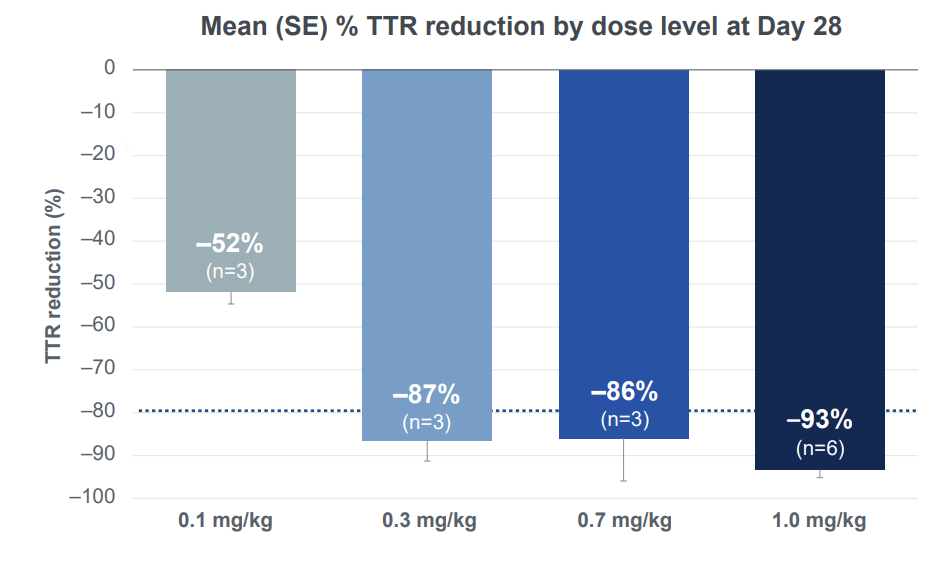
在最高剂量组(1.0mg/kg)中,6名接受治疗的患者在第28天平均血清 TTR 蛋白水平降低93%,最多降低98%。且在随访的6-9个月(3人随访时间达6个月,3人随访时间达9个月)中,这一降低水平得以保持,平均降低幅度为93%。
在0.7mg/kg剂量组中,第28天观察到的86%的平均血清 TTR 蛋白降低幅度也在随访的6个月里得以保持。
此外,在0.1mg/kg和0.3mg/kg组中,患者随访时间已达到12个月,血清 TTR 蛋白的降低幅度同样得以保持。值得注意的是,0.3mg/kg组的患者在12个月时平均血清 TTR 降低了89%。
Intellia 的总裁兼 CEO John Leonard 表示,这些中期数据更清晰地显示了 NTLA-2001 疗法对 ATTR 淀粉样变性患者的治疗潜力。这些数据进一步强调了基因组药物的力量,并提高了 Intellia 更广泛的体内基因组编辑平台成功的可能性,也期待推进首个全身给药的体内 CRISPR 疗法的临床开发。
NTLA-2002
2022年9月16日,Intellia 公布了其第二款体内 CRISPR 基因编辑疗法——NTLA-2002 的临床进展。
图片
遗传性血管性水肿(HAE)是一种罕见遗传性疾病,大约50000人中有1人患病。其特征是身体各个器官和组织中出现严重、反复和不可预测的炎症发作,让患者倍感痛苦、衰弱,甚至危及生命。目前的治疗选择通常是终身治疗,需要每周两次慢性静脉内给药或皮下注射给药,或每天口服给药。但即使长期用药,仍会发生突破性发作。而抑制激肽释放酶(kallikrein)是一种经过临床验证的预防遗传性血管性水肿(HAE)的策略。
NTLA-2002 的治疗原理是通过 LNP 递送 CRISPR 基因编辑靶向肝脏细胞的 KLKB1 基因,从而抑制激肽释放酶(kallikrein)的产生,进而抑制缓激肽(bradykinin)的产生,而缓激肽的过度产生会导致遗传性血管性水肿(HAE)的发作。

此次公布的数据来自这项1/2期临床试验的最初6名患者的治疗结果。两组各3名患者分别接受了25mg和75mg剂量的静脉注射治疗。检测结果显示,NTLA-2002 给药后导致血浆激肽释放酶(kallikrein)的剂量依赖性降低,并在第8周时达到最低,25mg和75mg剂量组的平均降低分别为65%和92%。

除了血浆激肽释放酶(kallikrein)水平外,该研究还测量了患者的遗传性血管性水肿(HAE)发作率,第一次分析发生在预先指定的16周主要观察期结束时。
结果显示,25mg剂量组中的患者在治疗开始前的发作率为平均每月1.1-7.2次。在整个16周的观察期内,单次治疗让他们的发作平均减少了91%。三名患者中有两名自治疗以来一次也没法发作过,所有三名患者在治疗第10周以后没有再发作过。
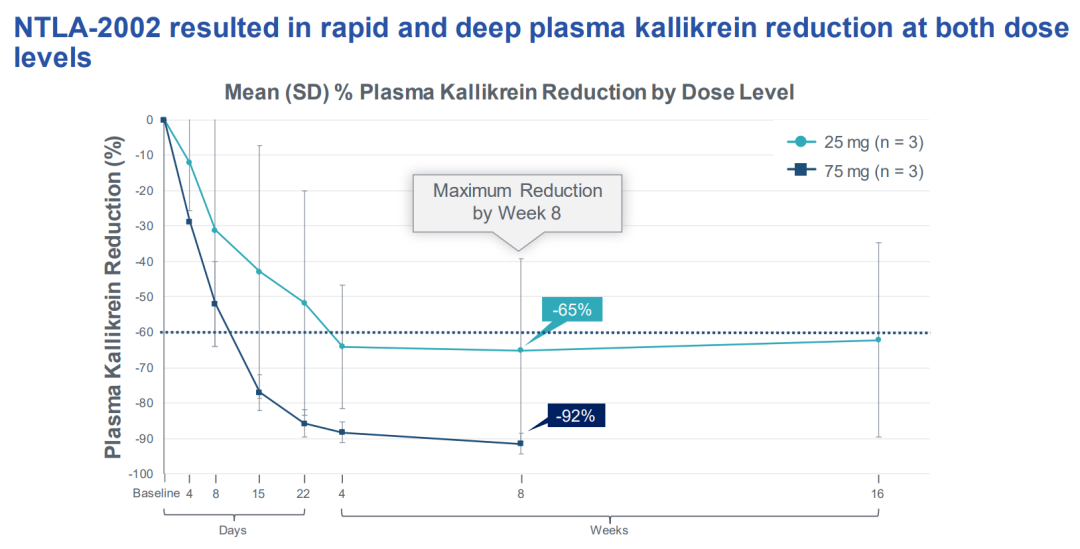
75mg组的患者尚未完成最初的16周观察期,因此尚未提供结果。
在25mg和75mg这两种剂量下,NTLA-2002 的耐受性普遍良好,大多数不良事件是轻微的。最常见的不良事件是输液相关反应,大多为1级,并在一天内得到解决。迄今为止,没有观察到剂量限制性毒性、严重不良事件和3级及以上的不良事件,也没有观察到临床上的显着异常。
Intellia CEO John Leonard 博士表示,这项临床试验的初步数据对于 Intellia 和世界各地患有遗传性血管性水肿(HAE)等遗传疾病的人们来说是一个重要里程碑。在25mg剂量组中观察到的减少90%以上疾病发作的结果非常鼓舞人心。这支持了单剂量 NTLA-2002 有可能永久预防遗传性血管性水肿(HAE)的发作。这些结果也再次印证了 Intellia 开发的基因组编辑方法和构建的模块化平台的威力。
这是历史上第二个体内 CRISPR 基因编辑疗法的临床数据,也再次表明可以精确地编辑人体内的靶细胞,从而通过单次、全身施用基于 CRISPR 的疗法来治疗遗传疾病。
Intellia 研发管线
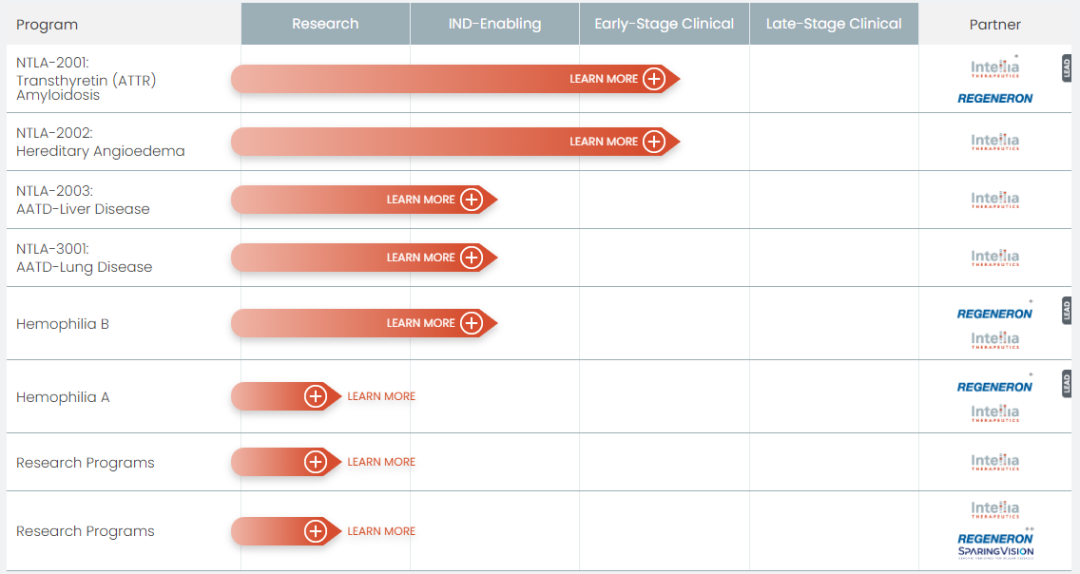
体内 CRISPR 疗法,目前共有8条管线,其中 NTLA-2001(治疗转甲状腺素蛋白淀粉样变性)和 NTLA-2002(治疗遗传性血管性水肿)正在进行临床试验。
另有 NTLA-2003(治疗α1-抗胰蛋白酶缺乏性肝病)、NTLA-3001(治疗α1-抗胰蛋白酶缺乏性肺病)和治疗血友病B型的疗法正在申请 IND,第一种为基因敲除型,后两种为基因插入型。
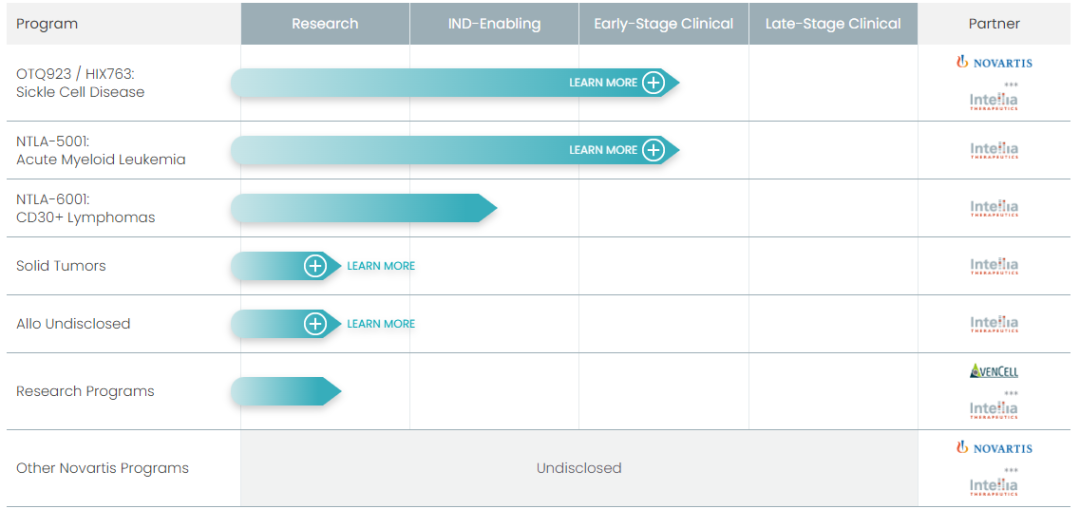
体外 CRISPR 疗法,目前共有7条管线,其中治疗镰状细胞病和治疗急性髓细胞白血病的疗法正在进行临床试验,以及一款治疗 CD30 阳性淋巴瘤的通用型 CAR-T 疗法正在申请 IND。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言