我国科学家利用CRISPR-Cas9技术在CAR-T细胞中实现多基因编辑
2016-12-10 中科院动物研究所 中科院动物研究所
CART(Chimeric Antigen Receptor T cell)细胞治疗是非常有前景的肿瘤治疗方法,中文翻译为“嵌合抗原受体T细胞”。嵌合抗原受体(Chimeric Antigen Receptor,CAR)是由人工设计合成的跨膜蛋白,包括细胞外、跨细胞膜以及细胞内三个部分。CAR的细胞外部分主要是识别特定抗原的单克隆抗体可变区(scFV),负责识别特异性抗原。跨膜区确保CAR可以在细
CART(Chimeric Antigen Receptor T cell)细胞治疗是非常有前景的肿瘤治疗方法,中文翻译为“嵌合抗原受体T细胞”。嵌合抗原受体(Chimeric Antigen Receptor,CAR)是由人工设计合成的跨膜蛋白,包括细胞外、跨细胞膜以及细胞内三个部分。CAR的细胞外部分主要是识别特定抗原的单克隆抗体可变区(scFV),负责识别特异性抗原。跨膜区确保CAR可以在细胞膜上定位,而细胞内区域则负责激活T细胞,产生T细胞介导的免疫反应。临床数据表明,CART在B细胞恶性肿瘤治疗中取得了很好的疗效。但是,目前采用的方法都是自体过继细胞治疗(autologous adoptive cell transfer,ACT),这种方法昂贵并且耗时。对于新生儿及老年患者,很难获得足量且状态良好的淋巴细胞用于CART细胞治疗。因此目前CART细胞治疗的一个重要研究方向是怎样使用一个健康献血者的T细胞制备大量的CART细胞,满足数百名患者的临床使用。这一技术的建立将极大降低CART疗法的成本,可以更好地保证统一制备的细胞质量,而且患者在需要时可以马上得到CART细胞进行治疗。
使用异体供者T细胞制备通用型CART用以治疗多个患者,必须保证其安全性,确保过继细胞不能攻击患者自身细胞,同时需要降低其自身的免疫原性避免宿主细胞的攻击。中国科学院动物研究所王皓毅研究组利用CRISPR-Cas9技术将αβT-cell receptor (TCR)从异体的CART细胞中敲除,避免移植物抗宿主病(graft-versus-host-disease,GVHD)的发生,将人类白细胞抗原(HLA)敲除降低自身的免疫原性。另外,PD-1是同肿瘤免疫逃逸相关的T细胞表面抑制因子,考虑到阻断PD-1信号通路在许多肿瘤类型中都取得了较好的疗效,研究人员同时在CART细胞中敲除了PD-1基因,来阻断PD-1信号通路。制备异体CART细胞需要进行多基因同时编辑,CRISPR-Cas9这一RNA介导的DNA核酸酶系统是非常适合的技术平台。在此项研究中,利用CRISPR-Cas9系统对CART细胞进行双基因(TRAC和B2M)或者三基因(TRAC,B2M及PD-1)敲除。结果表明,这些经过基因编辑的CART细胞同普通CART细胞相比,在体外及体内具有相当或更强的肿瘤细胞杀伤功能,有望成为临床应用的效应细胞。基因编辑技术联合过继免疫在肿瘤及HIV/AIDS治疗中具有广泛的应用前景,这一方法的建立为这些疾病治疗的研究奠定了坚实的技术基础。
该项研究在12月2日以CRISPR-Cas9 mediated multiplex gene editing in CAR-T cells 为题在线发表于《细胞研究》(Cell Research)。这一工作由中科院动物所王皓毅研究组与宣武医院以及北京脐带血库合作完成,刘晓娟、张永平和程晨为论文共同第一作者。该研究得到了干细胞与生殖生物学国家重点实验室研究员、中科院院士周琪以及各位同事的大力帮助和支持,同时得到了科技部“863”课题、国家自然科学基金和中科院干细胞先导专项的资助。
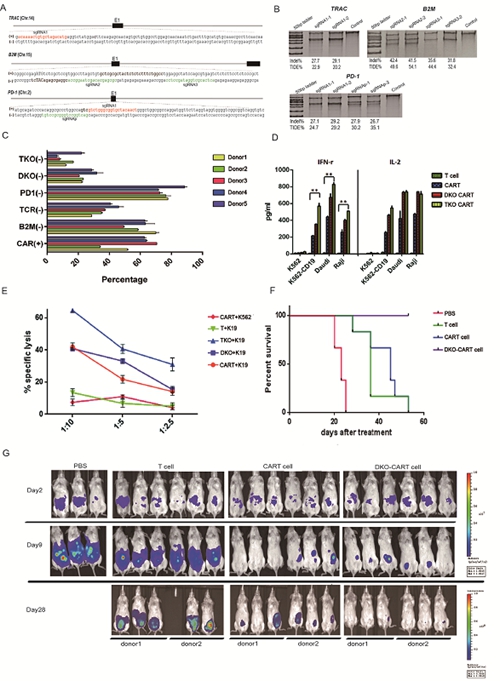
利用CRISPR-Cas9系统实现在CART细胞中的多基因编辑
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#多基因#
57
#CAR-#
62
#CRISPR#
97
#CRISPR-Cas9#
81
#Cas9#
52
#CRISPR-Cas#
63
#Cas#
50
厉害。
82
学习了这些
83