【Hemasphere】CAR-T治疗LBCL,欧洲患者预后劣于美国患者的影响因素有哪些?
2023-07-25 聊聊血液 聊聊血液 发表于上海
《Hemasphere》近日发表一项国际多中心回顾性观察性研究,旨在描述患者基线特征、过渡治疗和 CAR-T 细胞产品使用的差异,以及它们与CAR-T后临床结局的关系。
影响CAR-T疗效的因素
大B细胞淋巴瘤(LBCL)中3线CAR-T细胞疗法的真实世界证据与关键研究一致,但不同地区或CAR-T 细胞产品报告的预后差异较大。影响CAR-T细胞治疗真实世界结局的因素包括:纳入患者的标准、生产周期的差异和桥接治疗的必要性;转诊模式的地区特异性和中心特异性差异以及定义资格的细微差别(例如自体干细胞移植前评估免疫化疗无反应的差异,或合并器官功能的受损程度);地区和 CAR-T 产品的保险授权、白细胞单采和生产插槽的等待时间;过渡治疗的给药和性质,包括指征-白细胞单采之间的细胞减灭术治疗(称为holding therapy)和单采-输注之间的(生产期间)桥接治疗;具有已知不良预后影响(包括肿瘤负荷和炎症)的基线和动态患者特征的地区范围和产品特异性差异。
《Hemasphere》近日发表一项国际多中心回顾性观察性研究,旨在描述患者基线特征、过渡治疗和 CAR-T 细胞产品使用的差异,以及它们与CAR-T后临床结局的关系。
研究方法
该回顾性观察性研究共有美国、德国、西班牙6家中心参与,患者根据FDA或EMA批准的说明书接受axi-cel或tisagenlecleucel (tisa-cel)用于复发/难治性 (R/R) 大 B 细胞淋巴瘤 (LBCL) 三线或三线以上治疗,但纳入了按照扩大使用方案接受不合格 CAR T 细胞产品的患者。
在治疗过程中的多个时间点评估静态和动态患者特征:
(1) 指征(indication)时(通常定义为肿瘤委员会决定确认 CAR-T 治疗的资格,或者在获得 CAR-T 知情同意的首次访视时);
(2) 白细胞单采时;
(3) 清淋前即刻。
采用 ASTCT 共识标准对 CRS 和 ICANS 进行分级。根据 2014 Lugano 分类在当地评估缓解。
研究结果
CAR-T治疗前,欧洲患者的静脉-静脉间隔较长且存在不良预后标志物组合
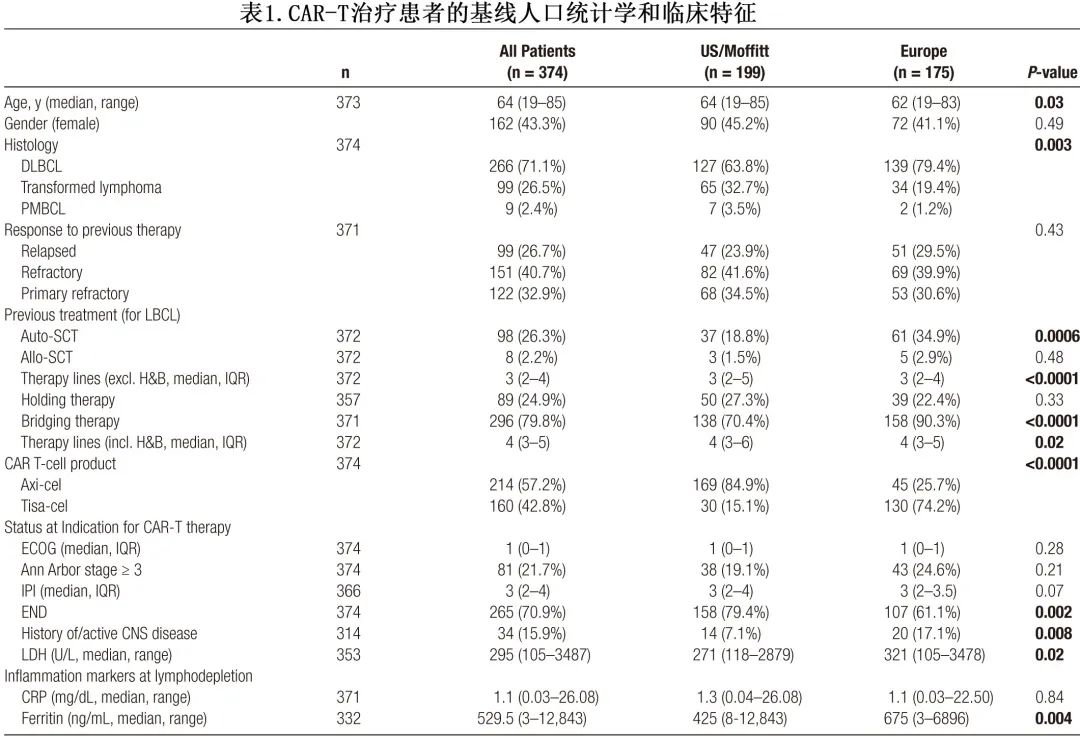
该真实队列共有374例患者,中位年龄为64岁,指征时中位ECOG体能状态为1,中位IPI为3(表1)。患者既往接受的治疗线中位数为3,包括98例既往接受过 ASCT 的患者 (26%)。265例患者 (71%) 存在结外疾病表现,包括34例患者 (16%) 有中枢神经系统疾病史或活动性中枢神经系统疾病。
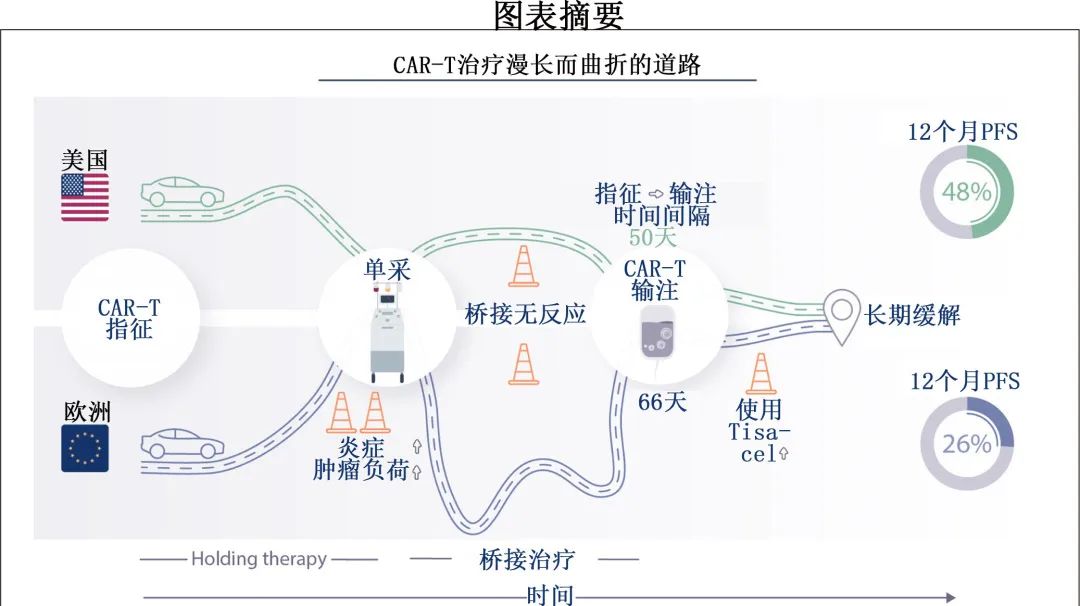
在欧洲 (EU) 接受治疗的患者与美国患者相比,指征至输注的平均时间明显更长 (66 vs 50 天;P<0.001)(图 1A 和1B),主要是由于欧洲患者白细胞单采和 CAR-T 输注之间的平均时间间隔较长,即所谓的静脉-静脉间隔 (49 vs 30天;P<0.001);与之相反,美国患者的指征至单采平均时间略长(20天 vs 17 天)。
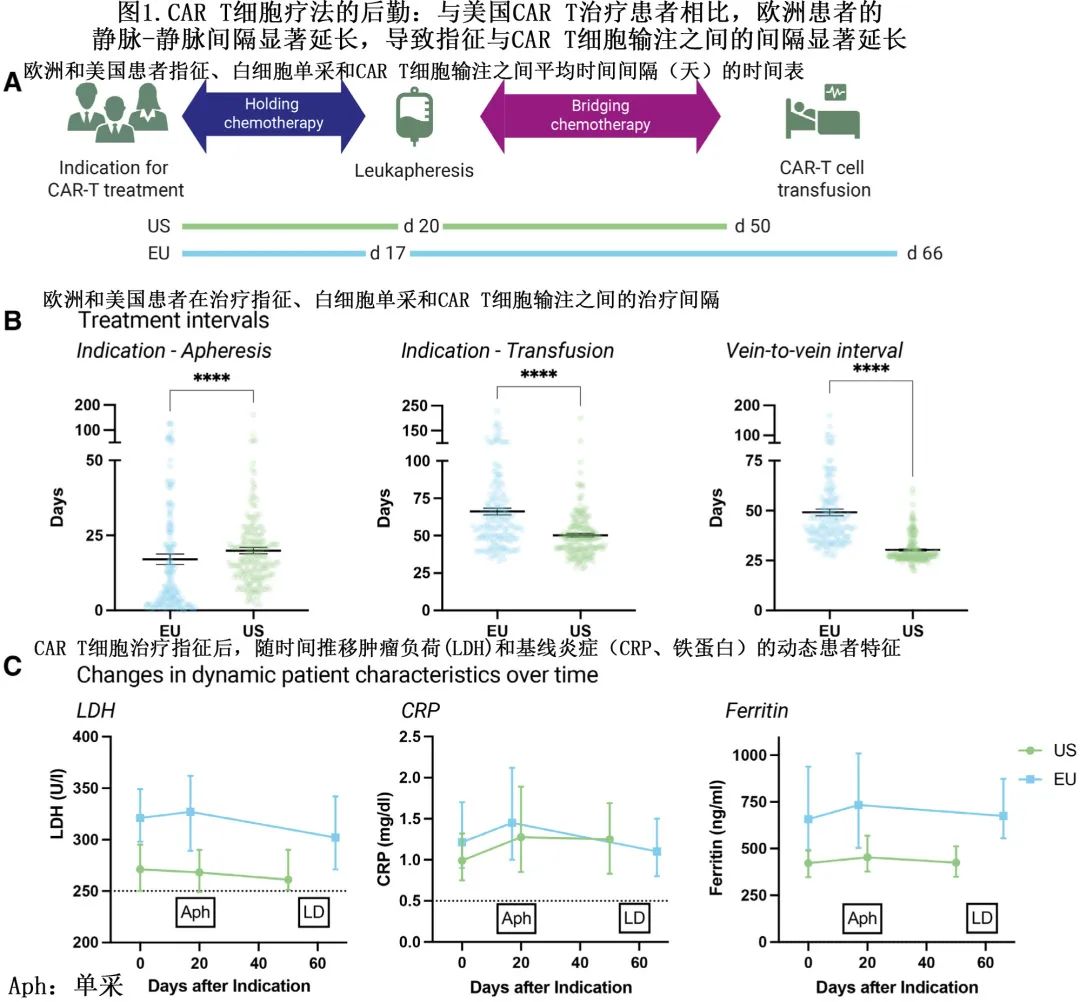
人口统计学和实验室特征方面,欧洲患者的乳酸脱氢酶 (LDH) 水平显著升高,包括指征(中位数321 vs 271 U/L;P=0.02)、单采(中位数327 vs 268 U/L;P=0.007)和清淋前(中位数302 vs 261 U/L;P=0.04;图1C)。两个研究队列的 C 反应蛋白 (CRP) 水平相当(中位数1.45 vs 1.29 mg/dL;P=0.72)。此外欧洲患者的铁蛋白在所有研究时间点均显著升高,尤其是在单采(中位数734 vs 439 ng/mL;P=0.004)和清淋(中位数675 vs 425 ng/mL;P=0.004)时。
其他基线人口统计学和疾病特征方面,美国患者的中位年龄较高(64岁 vs 62 岁;P=0.03)(表1)。美国队列中更常转化型淋巴瘤更多 (33% vs 19%),而在欧洲队列中活动性或中枢神经系统 (CNS) 疾病史的患者更多(17% vs 7%;P=0.008)。美国患者既往治疗线数较高 (P<0.001),而欧洲患者中既往接受过 ASCT 的比例较高 (35% vs 19%;P<0.001)。Axi-cel 在美国队列中更常用(169/199例患者,85%),而 tisa-cel 在欧洲更常用(130/175例患者,74%)。值得注意的是,tisa-cel-治疗的患者静脉-静脉间期更长,并富集了高危基线特征。总体而言,这些数据表明,欧洲患者在CAR-T输注前表现出预后不良风险特征,包括CAR-T后勤延迟、肿瘤体积更高(表现为替代标志物LDH较高)和更明显的全身性炎症(表现为铁蛋白较高)。
不同地区的holding therapy和桥接治疗模式也不同
指征-白细胞单采之间的细胞减灭术治疗称为holding therapy。大多数患者接受了指征和 CAR-T 输注之间的过渡治疗(307/368,83%),包括89/357例 (25%) 接受holding therapy和296/371例 (80%) 接受桥接治疗。在所有患者中,过渡治疗包括化疗215例 (57%)、免疫治疗27例 (7%)、靶向小分子治疗30例 (8%) 和放疗65例 (17%)。61例患者 (16%) 既未接受holding therapy也未接受桥接治疗。Tisa-cel的桥接治疗多于axi-cel(94% vs 73%;P<0.0001)。
所有过渡治疗的总缓解率为27%,其中含免疫治疗方案的缓解率最高 (38%),其次是化学免疫治疗 ([CIT],35%) 和小分子治疗 (28%)。在后续对 CD19 CAR-T 产生应答的患者中,多数未接受holding therapy/桥接治疗或对holding therapy/桥接治疗无应答(图2A)。在对过渡治疗应答的患者中,治疗后血清LDH水平显著较低(0.9倍变化;P<0.001;图2B),而对过渡治疗无应答患者的血清CRP(1.3倍;P<0.001)和铁蛋白水平(1.2倍;P<0.001)显著较高(图2B)。
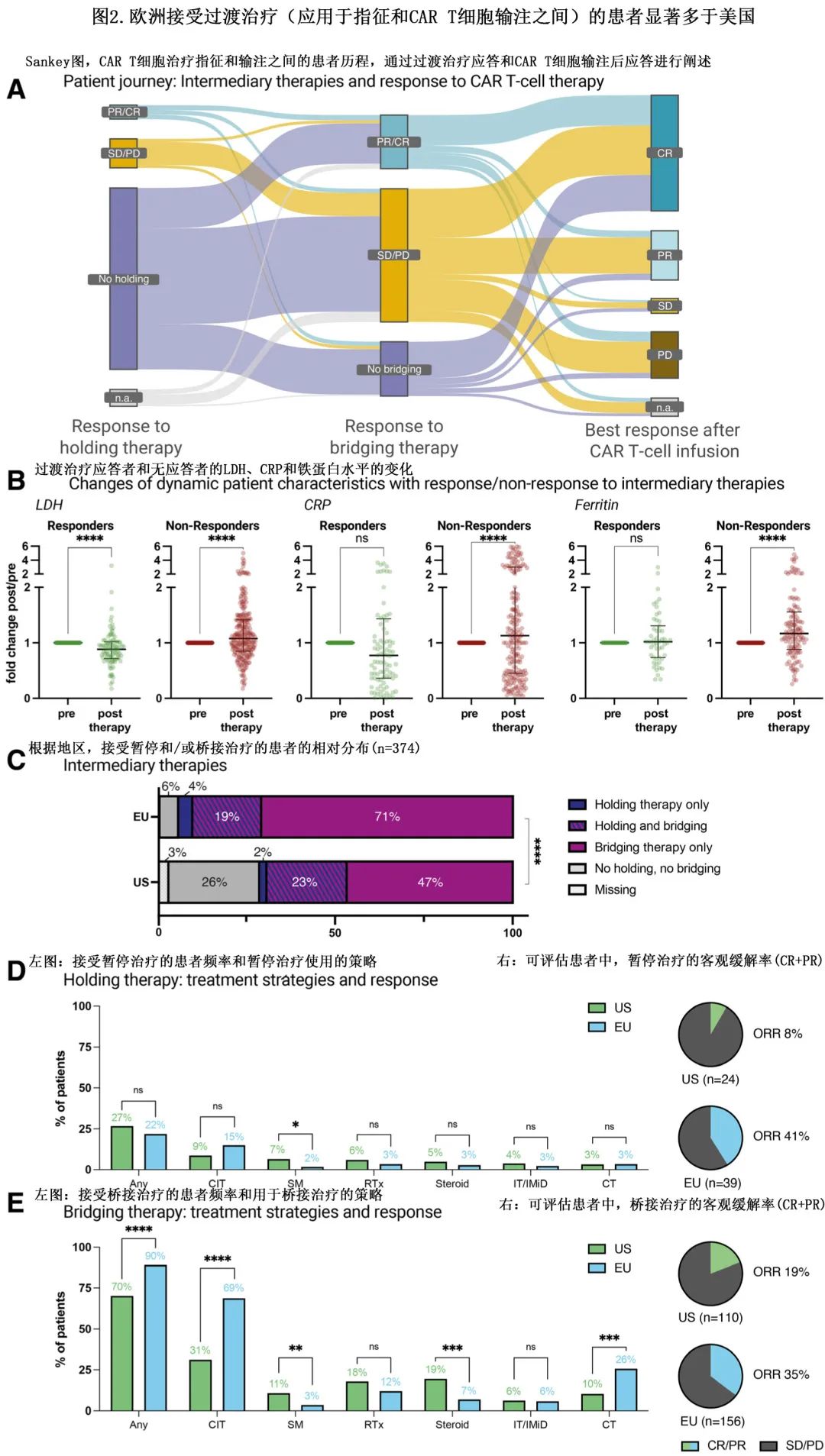
欧洲和美国队列中接受holding therapy的频率相似 (22% vs 27%;P=0.33),但欧洲患者接受桥接治疗的频率较高 (90% vs 70%;P<0.001)(图2C),因此美国患者中未接受任何过渡治疗的比例更高(6% vs 26%;P<0.001)。此外应用的暂停和桥接治疗策略也不同,与美国队列中更频繁使用糖皮质激素 (9% vs 25%;P<0.001)、放疗和小分子(例如BTK或 PI3K 抑制剂)相比,欧洲更常规给予化疗 (28% vs 13%;P=0.006) 和CIT(66% vs 34%;P<0.001)(图2D–2E)。欧洲接受holding therapy的缓解率为41%(39例可评估患者),美国为8%(24例可评估患者)(图2D;P=0.005);欧洲患者对桥接治疗的应答率也较高 (35% vs 19%;P=0.006)(图2E)。这些数据强调了不同地区过渡疗法应用的差异。
不同地区的产品特异性毒性和NRM率相当
患者队列之间的重度 CRS 和托珠单抗应用率相当(图3A),但美国患者中≥3级 ICANS 的发生率较高(25% vs 9%;P<0.001;图3B),可能是由于axi-cel的占比优势所驱动。同时,大剂量糖皮质激素在美国 (48% vs 37%;P=0.04) 和axi-cel(52% vs 31%;P<0.001)队列中的应用更频繁。
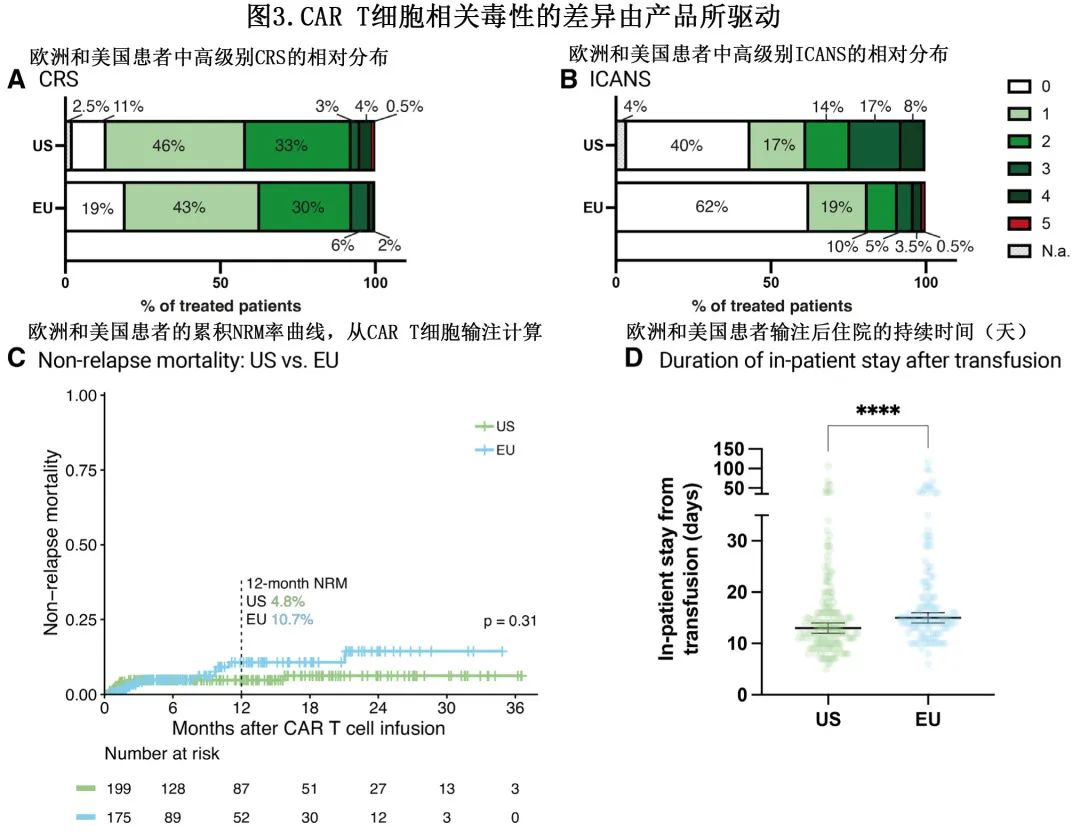
欧洲与美国的1年 NRM 率分别为10.7%和4.8%,治疗相关死亡率无显著差异(P=0.31;图3C)。此外不同CAR 产品的1年 NRM 无显著差异(tisa-cel与axi-cel为9.4%与6.0%,P=0.91)。欧洲的住院时间较长,中位住院天数分别为15天和13天(P<0.001;图3D)。
疾病和宿主内在差异以及CAR-T产品导致欧洲患者的预后较差
各研究队列的 PFS 和总生存期 (OS) 分析显示,欧洲患者的生存结局显著较差(图 4A 和4B)。欧洲与美国患者的中位 PFS 分别为3.1和9.2个月 (P<0.001),而中位 OS 分别为10.9个月和未达到 (P<0.001),欧洲患者 PFS 和 OS 的风险比 (HR) 分别显著增加1.8和1.9。美国队列的最佳总体缓解率 (74%) 高于欧洲队列 (62%),完全缓解率分别为58%和38%(图4E)。值得注意的是,直接比较 CAR 产品时仍有生存差异,接受tisa-cel治疗的患者预后较差,且在欧洲和美国亚队列的 PFS 以及欧洲患者的 OS 方面也存在明显差异(图 4C 和4D)。
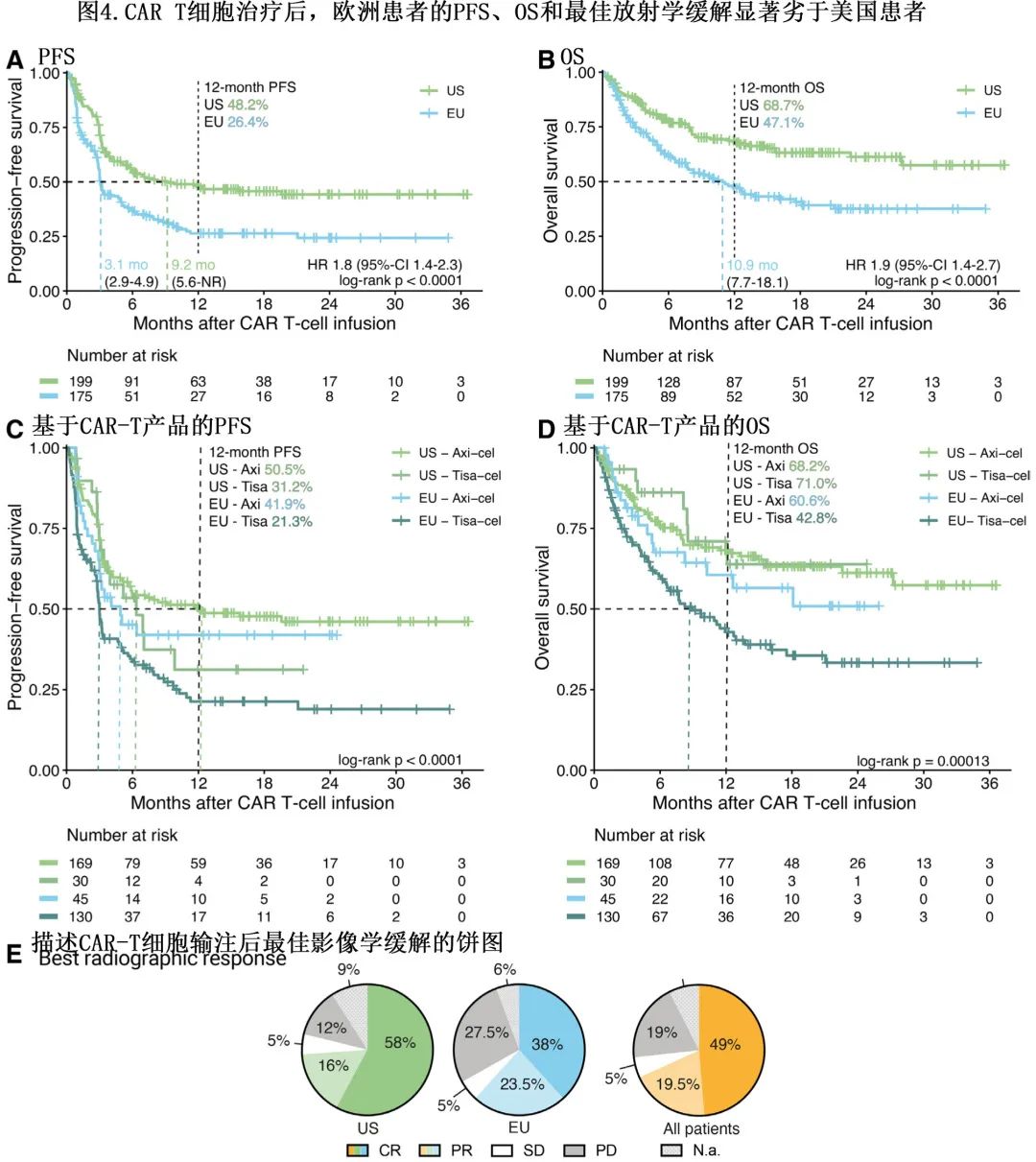
为了了解哪些变量(除了 CAR-T 产品使用的差异)驱动本队列的生存差异,作者进行了单变量和多变量建模(表2)。在单变量 Cox 回归分析中,对桥接无应答、血清铁蛋白和 CRP 水平升高以及使用 tisa-cel 是特别的不良预后因素(所有P<0.001),其他不良风险特征包括 ECOG 体能状态较差和血清 LDH 升高(表2)。随后将单变量 Cox 回归中确定的P≤0.1的潜在预后标志物引入多变量 Lasso 模型中;排除CAR产品的使用,因为旨在确定产品非依赖性风险因素。值得注意的是,仅桥接无应答(Lasso系数0.35)、清淋时的血清铁蛋白(Lasso系数0.1)和清淋时的血清CRP(Lasso系数0.01)仍为进展的独立风险因素。
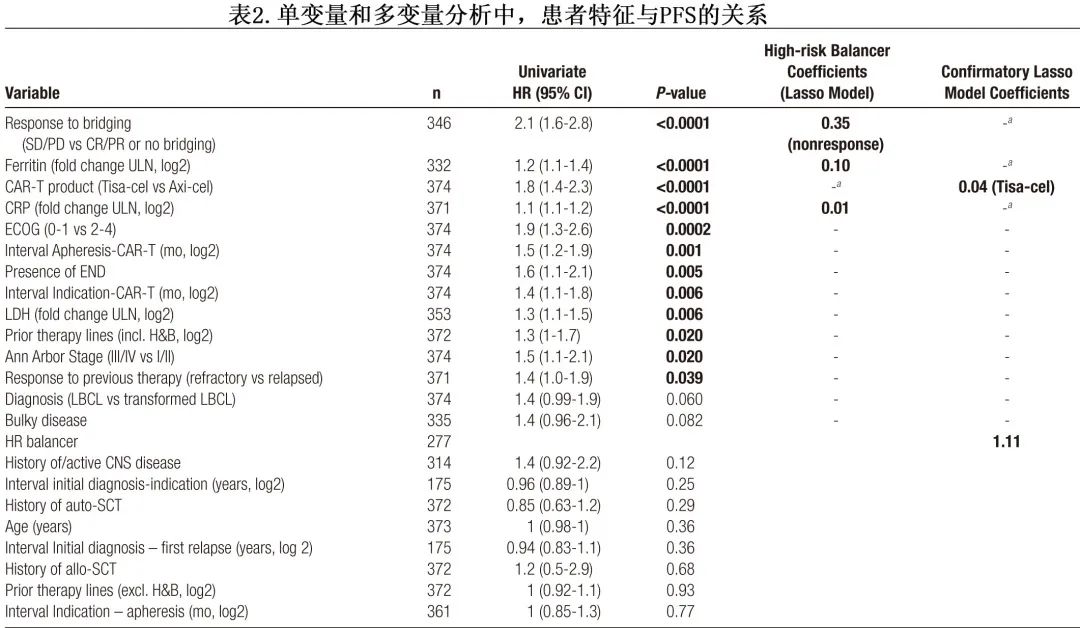
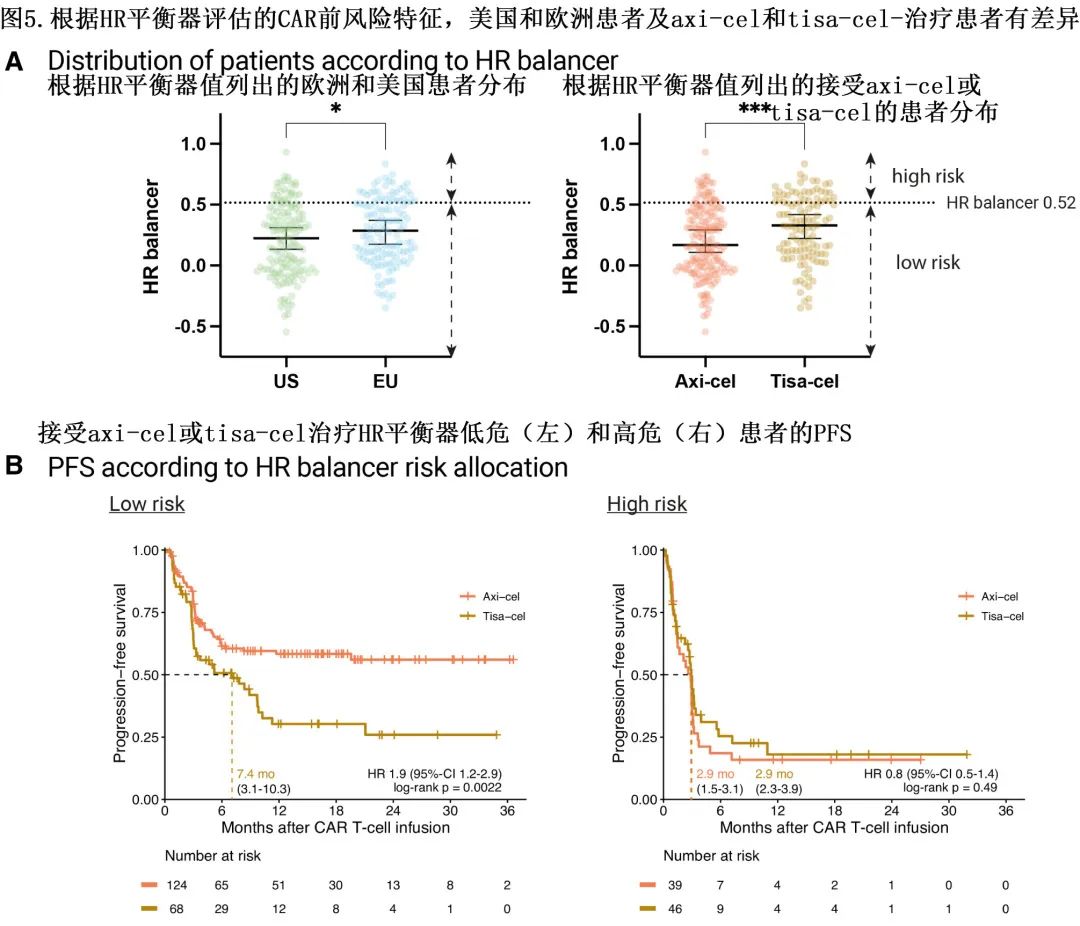
低危患者中Axi-cel生存更佳
为了进一步描述哪些患者特别受到 CAR 产品选择的影响,根据多变量Lasso模型得出的系数计算了风险分类评分(表2;n=277),高危平衡器(high risk balancer,HR balancer,分数越高预后越差)计算如下:高危平衡器=0.35 × 1(桥接无应答)+ 0.1×铁蛋白(倍数变化ULN,log2)+ 0.01×CRP(倍数变化ULN,log2)。根据模型,欧洲接受 tisa-cel 治疗的患者评分显著较高(图5A)。在具有特别高危特征的患者中未发现显著的 PFS 差异,但具有低危特征的患者中tisa-cel的 PFS 显著较差 (HR=1.9);tisa-cel组的中位 PFS 为7.4个月,而 axi-cel 组未达到,OS的结果也一致。
总结
在该项多中心回顾性观察性研究中,作者在欧洲和美国接受tisa-cel或axi-cel治疗的374例患者中研究了从 CAR-T指征至输注的患者个体病程、基线特征和生存结局。与美国患者相比,欧洲患者的指征-输注间隔较长(66天 vs 50 天;P<0.001),接受过渡治疗的频率更高(包括holding thearpy和/或桥接治疗,欧洲 94% vs 美国74%;P<0.001),使用tisa-cel的比例也更高(74% vs 15%),基线乳酸脱氢酶 (LDH)(中位数321 vs 271 U/L;P=0.02)和铁蛋白水平 (675 vs 425 ng/mL;P=0.004)也显著升高。总体而言,欧洲患者(中位PFS 3.1个月 vs 美国9.2个月;P<0.001)和 tisa-cel 患者(3.2个月vs axi-cel 9.2个月;P<0.001)的生存期较差。在多变量 Lasso 模型中,对桥接无应答、铁蛋白升高和 C 反应蛋白升高是治疗失败的独立风险。将这些变量加权到患者个体风险平衡器(高危平衡器)中,发现欧洲队列风险高于美国队列、tisa-cel高于axi-cel 队列。
值得注意的是,axi-cel的 PFS 优效性仅在低进展风险患者中明显(根据高危平衡器),但在高危患者中不明显。这些数据表明,欧洲患者较差的生存结局与较长的输注时间间隔、较高的肿瘤负荷/LDH 水平、全身炎症标志物增加和 CAR-T 产品使用相关。
该研究揭示了欧洲和美国患者队列之间 CAR-T 细胞给药和患者特征的重要差异,从而导致临床结局的显著差异;此外axi-cel 在低危患者组中特别有效。未来的研究将需要考虑患者特征和后勤方面的微妙之处,以优化患者选择和 CAR-T 治疗结局。
参考文献
Bücklein V,et al. Inferior Outcomes of EU Versus US Patients Treated With CD19 CAR-T for Relapsed/ Refractory Large B-cell Lymphoma: Association With Differences in Tumor Burden, Systemic Inflammation, Bridging Therapy Utilization, and CAR-T Product Use.Hemasphere . 2023 Jul 11;7(8):e907. doi: 10.1097/HS9.0000000000000907. eCollection 2023 Aug.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言