【专家述评】| 乳腺癌患者保乳手术后再次前哨淋巴结活检的最新研究进展及展望
2023-07-23 中国癌症杂志 中国癌症杂志 发表于上海
本文对以往关于再次前哨淋巴结活检相关的文献进行梳理和归纳,并就其可行性、安全性及临床应用价值进行综述,以供临床参考。
乳腺癌的手术发展经历了从“巨创”到“微创”的重大转变。1894年Halsted[1]首次提出了根治性乳房切除术,后人在此基础上进一步提出了扩大根治术以求最大程度地控制病灶。20世纪中后期,保乳治疗应运而生,旨在最大程度地控制病灶,同时仅对患者造成最小程度的伤害。迄今为止,多项随机对照临床试验的长期随访(>20年)结果显示,保乳手术与乳房切除术的总体预后相当(NSABP06[2]、米兰-1[3]及DBCG-82TM[4]),而保乳术后的放疗和全身辅助治疗令术后10年内同侧乳房内复发的概率被控制在5%~15%[5-7],10年和20年的局部复发率分别为4%~6%及10%~15%[8]。
由于淋巴结状态是乳腺癌重要的预后因素,正确评估和管理腋窝淋巴结对乳腺癌患者至关重要。此前很长一段时间腋窝淋巴结清扫(axillary lymph node disp,ALND)都被作为腋窝分期金标准,但可能伴随着一系列的并发症,如淋巴水肿、手臂活动受限、无力以及感觉异常等[9]。前哨淋巴结是指淋巴结转移所经过的第一站淋巴结,通常是腋窝淋巴结,也可能是内乳淋巴结、乳腺内淋巴结以及胸肌间淋巴结[10]。1994年Giuliano等[11]将前哨淋巴结活检(sentinel lymph node biopsy,SLNB)首次应用于乳腺癌。后经长期随访结果证实,如果SLNB为阴性或微转移,则无需进一步进行腋窝清扫手术[12-16]。近来通过ACOSOG Z0011试验发现,即便前哨淋巴结有少量负荷的宏转移,接受保乳手术联合全乳放疗的患者也可以豁免腋窝清扫[17-18]。多项研究[19-22]都证明SLNB相对于腋窝清扫的假阴性率为5%~10%,而实际随访过程中SLNB阴性患者不行腋窝清扫的腋窝复发率仅为0.0%~1.5%。因此,SLNB已替代ALND成为临床淋巴结阴性(clinical lymph node negative,cN0)乳腺癌患者的标准腋窝分期治疗方法,并得到广泛应用。2005年,美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)首次认可了SLNB在腋窝淋巴结分期中的作用[23]。自此,SLNB受到了国内外许多医院的青睐并得到大力推广。中国近期一项在全国范围内手术量>200例的医院问卷结果显示,110家参与问卷调查的医院均进行了SLNB,且其中85家医院对超过50%的淋巴结阴性的患者进行了常规的SLNB[24]。
随着保乳手术的增加,保乳术后同侧乳房内复发(ipsilateral breast tumor recurrence,IBTR)患者的例数随之增加,而IBTR患者如何进行恰当的腋窝分期成为了一个颇受临床关注的话题。2001年,Zgajnar等[25]首次提出是否应该对保乳治疗后孤立局部复发的患者进行再次前哨淋巴结活检(repeat sentinel lymph node biopsy,rSLNB),以及其是否可用于预测腋窝淋巴结状态。2002年,Chung等[26]对1例孤立性乳腺复发患者行rSLNB的报告回复了该问题。该患者初诊后接受了乳房肿瘤局部广泛切除术和SLNB,未接受全乳放疗或辅助化疗,后出现孤立性乳房复发,行rSLNB,通过放射性核素定位,前哨淋巴结得到了很好的识别。在此之后,rSLNB开始不断受到关注。
1 rSLNB的理论基础及可行性
已知SLNB需要原发肿瘤或复发部位存在完整的淋巴引流,但既往的腋窝手术(ALND或SLNB)和放疗可能会部分或全部破坏原来的淋巴引流系统。Intra等[27]在研究中提出了“动态前哨淋巴结”的概念:不是一个永远不变的前哨淋巴结,但总会出现一个新的前哨淋巴结。即中断的淋巴液流动在一定时间后会恢复,当以往的腋窝操作和疾病复发之间有充足的时间时,可以在乳房与腋窝之间形成新的淋巴引流“桥梁”。新的淋巴通路可以出现新的前哨淋巴结,即新肿瘤的前哨,这也是rSLNB得以实施的理论基础。但同时还有学者认为,肿瘤复发后的淋巴引流模式可能比想象的复杂,淋巴引流被破坏后淋巴液可能沿着副淋巴管进入替代的淋巴结区域[28-29],所以可能存在意想不到的异常淋巴引流途径,这会给rSLNB的检出率和准确性带来一定的挑战。
为了获得rSLNB可行性的循证医学依据,近些年来一系列临床研究不断开展。目前纳入人数最多的来自荷兰的前哨淋巴结和复发的乳腺癌(sentinel node and recurrent breast cancer,SNARB)多中心研究[30],对共计536例局部复发的非转移性乳腺癌患者施行了同位素淋巴成像和rSLNB。此外,Poodt等[31]于2018年对34篇有关rSLNB相关文献、总计1 761例患者进行了系统评价,为临床评估rSLNB的可行性提供了丰富的循证医学依据。欧洲一项研究也指出rSLNB适用于IBTR以及既往保乳术后同侧新发肿瘤的患者,其应取代常规ALND作为临床阴性腋窝的复发性疾病患者的腋窝再分期方式[32]。
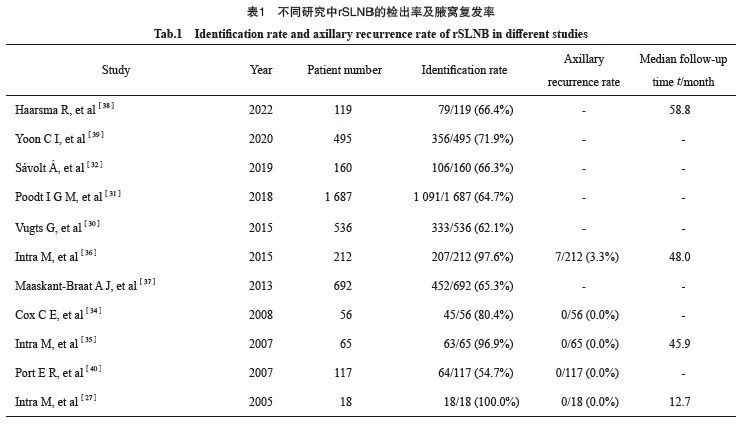
根据文献报道,rSLNB的检出率为54.7%~100.0%[27,30-40](表1)。既往不同的腋窝手术操作对rSLNB的检出率有一定的影响。一项包含692例局部复发乳腺癌患者行rSLNB的meta分析结果显示,rSLNB的检出率为65.3%,在既往接受SLNB治疗的患者中明显高于既往ALND患者(P<0.000 1)。同时43.2%的术前淋巴闪烁成像定位成功的患者可见同侧腋窝以外的异常引流[37]。荷兰一项前哨淋巴结和复发性乳腺癌(sentinel SNARB)研究[30]发现rSLNB检出率为62.1%,同时大约54.1%的患者出现了异常的淋巴引流,主要的异常引流部位为对侧腋窝和同侧内乳,更多发生在既往行ALND的患者中(P<0.001)。Schrenk等[41]也发现rSLNB检出率与淋巴闪烁成像成功定位有明显的相关性,因此他们提出对于IBTR的患者,应在手术时进行淋巴闪烁成像。
既往仅接受过SLNB的IBTR患者的回顾性研究表明rSLNB的成功率为72.2%~80.4%[42]。而回顾性分析发现与rSLNB成功相关的因素还包括初始手术中切除的腋窝淋巴结数目、rSLNB与初始手术的间隔时间以及初始手术乳腺切除的范围[43]。
目前所有rSLNB研究中淋巴示踪的方法与初次行SLNB的方法类似,即采用放射性示踪剂和(或)蓝色染料。Vugts等 [44]在研究中发现注射更高剂量(>180 MBq)的99mTc示踪剂可以明显提高局部复发乳腺癌患者中rSLNB的检出率(OR=4.40),同时对于既往行保乳手术的患者,乳晕下注射示踪剂与肿瘤周围下注射相比,rSLNB有更低的检出率(OR=0.34)。但Guru等[45]的单中心、回顾性研究得出了不一样的结论,该研究纳入141例肿瘤切除术后尝试进行rSLNB的乳腺癌患者,发现乳晕周围和肿瘤周围注射示踪剂,前哨淋巴结的检出率相似。因此,未来仍需付出更多的努力,探索不同注射位点对rSLNB检出率的影响。
对于rSLNB是否对既往乳房切除手术后局部胸壁复发的患者同样可行,目前相关研究并不多。Karam等[33]曾经报道一组小样本的研究,于乳房切除术切口上方使用放射性同位素进行定位,注射或不注射蓝色染料,rSLNB的成功率为65%。最近发表的一项多中心研究纳入了89例乳腺癌乳房切除后局部复发、无远处转移、临床和超声腋窝均阴性、既往接受SLNB且未进行腋窝清扫的患者,采用rSLNB,成功率为99%,其中14%的患者提示有转移,中位随访3.7年,总生存(overall survival,OS)率为96.7%,无病生存(disease-free survival,DFS)率为84.4%[46]。
2 rSLNB替代腋窝清扫的安全性
目前临床上对既往仅接受SLNB的IBTR患者是否需要腋窝清扫还存在争议。反对者认为大多数IBTR患者经过腋窝清扫并未发现有淋巴结转移,而随着非侵入性影像学诊断技术的发展和应用[包括超声检查、正电子发射计算机体层成像(positron emission tomography and computed tomography,PET/CT)等],强制对每例IBTR患者施行ALND来评估腋窝是否转移的理由也正在逐渐减弱[31]。因此,rSLNB首先需要被证明的临床应用价值就是替代这一部分IBTR人群的腋窝清扫。
回顾既往文献,IBTR患者行rSLNB阴性后同侧腋窝复发率低于5%(表1)。Poodt等[31]发现平均随访31.7个月后,1.3%的患者发生区域淋巴结复发。另一项研究[47]发现,IBTR后阴性rSLNB患者中位随访4.7年后,4.5%的患者出现了区域复发,腋窝复发率为1%,中位复发时间为3年。Intra等[36]发现约有80%的IBTR患者rSLNB结果为阴性,而该队列5年随访数据显示阴性rSLNB患者的同侧腋窝复发率为3.9%,是迄今随访时间最长的一项研究。基于既往的研究进展,中国抗癌协会发布的《乳腺癌前哨淋巴结活检规范化操作指南(2022精要版)》[48]对SLNB的适应证及流程进行了详细的总结。指南中指出对于保乳术后的IBTR患者,rSLNB阴性豁免ALND后腋窝淋巴结复发的风险不足1%,该项技术的安全性和准确性已得到初步认可。但同时提出,对于既往有腋窝操作的患者,由于淋巴引流的重建需要一定时间,对于保乳术后短期内复发(2年)的患者行rSLNB应慎重考虑。
3 rSLNB对IBTR患者预后及治疗决策的意义
既往研究发现,IBTR经过治疗后相对于其他部位的复发预后较好,但依然存在较高远处转移风险和死亡风险。Voogd等[49]报道IBTR后64%的患者最终会发展为远处转移,大部分发生在IBTR后的前5年,10年OS率为39%。
已知与IBTR患者预后相关的因素有年龄、种族、体重指数(body mass index,BMI)、肿瘤大小、无病间期(disease-free interval,DFI,即初次手术与IBTR之间间隔时间)、雌激素受体状态、是否进行辅助治疗[50-52]。较早前,荷兰一项研究[53]已经发现,皮肤受累、复发程度(≤10 mm vs>10 mm)、原发疾病的淋巴结状态和组织学分级是复发患者出现远处转移的强预测因素。然而,复发后淋巴结状态对IBTR的预后影响究竟如何目前还不清楚。事实上,上述绝大多数研究都未将该指标纳入分析。例如,2015年Lee等[52]的一项研究评估了IBTR患者行二次手术后影响OS的相关因素,发现首次手术时的淋巴结状态与生存结局有关,但并未提供再次手术时淋巴结状态的相关信息。当前仅个别研究关注了rSLNB结果对IBTR患者预后的影响。一项研究[31]观察了IBTR患者中rSLNB阴性者术后远处转移的发生率,平均随访30.4个月,仅4.64%的患者出现了远处复发。而最近,Haarsma等[38]也发现阳性rSLNB的患者与阴性rSLNB或未成功进行rSLNB的患者相比,5年无复发生存(relapse-free survival,RFS)更差(P=0.004),但5年OS相当。该研究中将孤立肿瘤细胞纳入rSLNB阳性结果,但当排除2例此类患者之后,rSLNB结果对5年RFS影响的结论并未改变。不过,Ugras等[54]的一项研究纳入了初次手术时腋窝淋巴结阴性且后续出现IBTR或胸壁复发作为第一事件的83例浸润性乳腺癌患者,中位随访4.2年后分析进行腋窝手术和不进行腋窝手术的两组患者的腋窝失败、非腋窝部位复发、远处转移以及死亡的情况,发现差异无统计学意义。因此提出对于局部复发以及cN0的患者,rSLNB可行但并非必需,其对患者预后没有很大的影响。Poodt等[50]根据SNARB队列数据也得出了类似的结论,在临床淋巴结阴性的IBTR患者中,5年RFS率为79.1%,而阳性rSLNB、阴性rSLNB和未成功进行rSLNB患者间5年RFS差异无统计学意义(P=0.543),因此他们认为rSLNB的结果并无预后预测价值。该研究与Haarsma等[38]的研究的区别在于,SNARB队列入组患者数更多(515例 vs 119例),且为多中心研究,其中rSLNB阳性患者占比更高(8.9% vs 8.0%),5年总的RFS更差(79% vs 89%)。因此,rSLNB结果对患者预后的影响尚未有明确的结论,还需要更多包含预后资料的研究进行探索。
此前提到在一部分IBTR患者中可见异常的淋巴引流[35,42]。因此通过术前同位素淋巴闪烁成像和rSLNB可以获得异常淋巴引流区域内的肿瘤信息并可能重新分期[43]。
同时,rSLNB可能在辅助治疗决策中发挥作用。目前IBTR患者区域淋巴结评估的最佳方法尚未标准化。虽然IBTR患者通常已经有了全身治疗或者放疗的指征,而不必考虑rSLNB的结果如何。但如果rSLNB为阳性,甚至是发现并追踪到异常引流的情况,治疗方案就有可能发生变化,尤其是局部治疗的范围可能需要扩大[37]。SNARB研究[30]和Poodt等[31]指出应根据rSLNB结果进行的相应辅助治疗的调整。Maaskant-Braat等[37]的meta分析表明,17.9%的患者由于从rSLNB中获得的额外信息而改变了辅助放疗或全身治疗计划。
另外,rSLNB结果可以指导IBTR患者后续手术方式。Alpert等[55]提出IBTR后行再次保乳的患者与行乳房切除术的患者相比,虽然10年生存情况差异没有统计学意义,具有相当的结局,但是复发后淋巴结阳性与多灶性疾病相关,这类患者不推荐行再次保乳。
4 总结与展望
rSLNB对于保乳手术后IBTR的患者是可行的腋窝评估方法,如果结果为阴性则可以安全替代ALND来预防后者的并发症。但rSLNB的检出率远低于初次使用SLNB。同时,rSLNB在乳房切除术后局部胸壁复发的患者中的应用还缺乏大样本的研究数据支持。
在乳腺癌治疗越来越多地取决于肿瘤亚型而不是淋巴结状态的情况下,进行rSLNB是否对患者有益将更加难以抉择。尽管普遍认同rSLNB是目前针对IBTR最理想的腋窝评估手段,但其应用价值正受到一些非侵袭性影像学诊断手段(如FDG-PET/CT)的挑战[56-57]。Haarsma等[38]在研究中指出,对于采用FDG-PET/CT进行最优化临床分期为cN0的患者,由于阴性FDG-PET/CT患者发生阳性rSLNB的概率很低,且不改变总体生存情况,rSLNB在此类患者中的应用价值不高。rSLNB过程中观察到的异常淋巴引流和额外获得的分期,可能会对后续的治疗策略产生影响,但其对生存的影响仍没有明确的定论。因此,有必要开展前瞻性随机对照研究,来比较新型腋窝影像学检查评估为cN0的患者采取rSLNB或仅观察对IBTR患者预后的影响。
[参考文献]
[1] HALSTED W S. I. The results of operations for the cure of cancer of the breast performed at the Johns Hopkins Hospital from June 1889 to January 1894[J]. Ann Surg, 1894, 20(5): 497-555.
[2] FISHER B, ANDERSON S, BRYANT J, et al. Twenty-year follow-up of a randomized trial comparing total mastectomy, lumpectomy, and lumpectomy plus irradiation for the treatment of invasive breast cancer[J]. N Engl J Med, 2002, 347(16): 1233-1241.
[3] VERONESI U, CASCINELLI N, MARIANI L, et al. Twentyyear follow-up of a randomized study comparing breastconserving surgery with radical mastectomy for early breast cancer[J]. N Engl J Med, 2002, 347(16): 1227-1232.
[4] BLICHERT-TOFT M, NIELSEN M, DÜRING M, et al. Longterm results of breast conserving surgery vs mastectomy for early stage invasive breast cancer: 20-year follow-up of the Danish randomized DBCG-82TM protocol[J]. Acta Oncol, 2008, 47(4): 672-681.
[5] LI Y, LI W W, YUAN L, et al. Is repeat breast conservation possible for small ipsilateral breast cancer recurrence?[J]. Cancer, 2022, 128(22): 3919-3928.
[6] MO C Q, RUAN W H, LIN J Y, et al. Repeat breast-conserving surgery versus salvage mastectomy for ipsilateral breast tumour recurrence after breast-conserving surgery in breast cancer patients: a meta-analysis[J]. Front Oncol, 2021, 11: 734719.
[7] QU F L, LIN C J, LIU Z B, et al. Omission of axillary surgery for ipsilateral breast tumor recurrence with negative nodes after previous breast-conserving surgery: is it oncologically safe?[J]. Breast Cancer Res Treat, 2022, 196(1): 97-109.
[8] HANNOUN-LEVI J M, GAL J, SCHIAPPA R, et al. 10-Year oncological outcome report after second conservative treatment for ipsilateral breast tumor event[J]. Clin Transl Radiat Oncol, 2023, 38: 71-76.
[9] VERONESI U, PAGANELLI G, VIALE G, et al. A randomized comparison of sentinel-node biopsy with routine axillary disp in breast cancer[J]. N Engl J Med, 2003, 349(6): 546-553.
[10] SCHWARTZ G F, GIULIANO A E, VERONESI U, et al. Proceedings of the consensus conference on the role of sentinel lymph node biopsy in carcinoma of the breast, April 19-22, 2001, Philadelphia, Pennsylvania[J]. Cancer, 2002, 94(10): 2542-2551.
[11] GIULIANO A E, KIRGAN D M, GUENTHER J M, et al. Lymphatic mapping and sentinel lymphadenectomy for breast cancer[J]. Ann Surg, 1994, 220(3): 391-398; discussion: 398-401.
[12] CAUDLE A S, CUPP J A, KUERER H M. Management of axillary disease[J]. Surg Oncol Clin N Am, 2014, 23(3): 473-486.
[13] KRAG D N, ANDERSON S J, JULIAN T B, et al. Sentinellymph- node rep compared with conventional axillarylymph-node disp in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomised phase 3 trial[J]. Lancet Oncol, 2010, 11(10): 927-933.
[14] BILIMORIA K Y, BENTREM D J, HANSEN N M, et al. Comparison of sentinel lymph node biopsy alone and completion axillary lymph node disp for node-positive breast cancer[J]. J Clin Oncol, 2009, 27(18): 2946-2953.
[15] YI M, GIORDANO S H, MERIC-BERNSTAM F, et al. Trends in and outcomes from sentinel lymph node biopsy (SLNB) alone vs SLNB with axillary lymph node disp for node-positive breast cancer patients: experience from the SEER database[J]. Ann Surg Oncol, 2010, 17(3): 343-351.
[16] GALIMBERTI V, COLE B F, ZURRIDA S, et al. Axillary disp versus no axillary disp in patients with sentinelnode micrometastases (IBCSG 23-01): a phase 3 randomised controlled trial[J]. Lancet Oncol, 2013, 14(4): 297-305.
[17] GIULIANO A E, HUNT K K, BALLMAN K V, et al. Axillary disp vs no axillary disp in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial[J]. JAMA, 2011, 305(6): 569-575.
[18] GIULIANO A E, MCCALL L, BEITSCH P, et al. Locoregional recurrence after sentinel lymph node disp with or without axillary disp in patients with sentinel lymph node metastases: the American College of Surgeons Oncology Group Z0011 randomized trial[J]. Ann Surg, 2010, 252(3): 426-432; discussion 432-433.
[19] ALSUNITAN R I, AL-SAIF A, ALYOUSEF B A, et al. Axillary recurrence in breast cancer patients after negative sentinel lymph node biopsy: retrospective cohort study from Riyadh, Saudi Arabia[J]. Cureus, 2021, 13(12): e20132.
[20] KILUK J V, LY Q P, MEADE T, et al. Axillary recurrence rate following negative sentinel node biopsy for invasive breast cancer: long-term follow-up[J]. Ann Surg Oncol, 2011, 18(Suppl 3): S339-S342.
[21] POLETTI P, FENAROLI P, MILESI A, et al. Axillary recurrence in sentinel lymph node-negative breast cancer patients[J]. Ann Oncol, 2008, 19(11): 1842-1846.
[22] KILUK J V, LY Q P, SANTILLAN A A, et al. Erratum to: axillary recurrence rate following negative sentinel node biopsy for invasive breast cancer: long-term follow-up[J]. Ann Surg Oncol, 2010, 17(2): 552-557.
[23] LY M A N G H , G I U L I A N O A E , S O M E R F I E L D M R , et al. American Society of Clinical Oncology guideline recommendations for sentinel lymph node biopsy in early-stage breast cancer[J]. J Clin Oncol, 2005, 23(30): 7703-7720.
[24] 郭 瑢, 李 伦, 张 琪, 等. 中国乳腺癌前哨淋巴结活检现状调查研究[J]. 中国癌症杂志, 2020, 30(3): 166-173.
GUO R, LI L, ZHANG Q, et al. Current status of sentinel lymph node biopsy for breast cancer in China: a cross-pal study?[J]. China Oncol, 2020, 30(3): 166-173.
[25] ZGAJNAR J, GATZEMEIER W, COSTA A. Will the sentinel lymph node (SLN) stand a second time: SLN biopsy in breast cancer patients with isolated local recurrence following breast conserving therapy and previous SLN procedure[J]. Ann Oncol, 2001, 12(5): 723.
[26] CHUNG M A, CADY B. Caution urged with repeat sentinel lymph node biopsies[J]. Ann Oncol, 2002, 13(12): 1951.
[27] INTRA M, TRIFIRÒ G, VIALE G, et al. Second biopsy of axillary sentinel lymph node for reappearing breast cancer after previous sentinel lymph node biopsy[J]. Ann Surg Oncol, 2005, 12(11): 895-899.
[28] STELZNER F, FRIEDRICHS N, BÜTTNER R, et al. Lymph vascularity and lymph node metastases on PET and PET/CT: immunohistological and clinical observations[J]. Chirurg, 2005, 76(5): 493-500.
[29] REES W V, ROBINSON D S, HOLMES E C, et al. Altered lymphatic drainage following lymphadenectomy[J]. Cancer, 1980, 45(12): 3045-3049.
[30] VUGTS G, MAASKANT-BRAAT A J, VOOGD A C, et al. Repeat sentinel node biopsy should be considered in patients with locally recurrent breast cancer[J]. Breast Cancer Res Treat, 2015, 153(3): 549-556.
[31] POODT I G M, VUGTS G, SCHIPPER R J, et al. Repeat sentinel lymph node biopsy for ipsilateral breast tumor recurrence: a systematic review of the results and impact on prognosis[J]. Ann Surg Oncol, 2018, 25(5): 1329-1339.
[32] SÁVOLT Á, CSERNI G, LÁZÁR G, et al. Sentinel lymph node biopsy following previous axillary surgery in recurrent breast cancer[J]. Eur J Surg Oncol, 2019, 45(10): 1835-1838.
[33] KARAM A, STEMPEL M, CODY H S 3rd, et al. Reoperative sentinel lymph node biopsy after previous mastectomy[J]. J Am Coll Surg, 2008, 207(4): 543-548.
[34] COX C E, FURMAN B T, KILUK J V, et al. Use of reoperative sentinel lymph node biopsy in breast cancer patients[J]. J Am Coll Surg, 2008, 207(1): 57-61.
[35] INTRA M, TRIFIRÒ G, GALIMBERTI V, et al. Second axillary sentinel node biopsy for ipsilateral breast tumour recurrence[J]. Br J Surg, 2007, 94(10): 1216-1219.
[36] INTRA M, VIALE G, VILA J, et al. Second axillary sentinel lymph node biopsy for breast tumor recurrence: experience of the European institute of oncology[J]. Ann Surg Oncol, 2015, 22(7): 2372-2377.
[37] MAASKANT-BRAAT A J, VOOGD A C, ROUMEN R M, et al. Repeat sentinel node biopsy in patients with locally recurrent breast cancer: a systematic review and meta-analysis of the literature[J]. Breast Cancer Res Treat, 2013, 138(1): 13-20.
[38] HAARSMA R, VAN LOEVEZIJN A A, DONSWIJK M L, et al. Added value of repeat sentinel lymph node biopsy in FDGPET/CT node-negative patients with ipsilateral breast cancer recurrence[J]. Breast Cancer Res Treat, 2022, 194(3): 617-627.
[39] YOON C I, AHN S G, KIM D, et al. Repeat sentinel lymph node biopsy for ipsilateral breast tumor recurrence after breast conserving surgery with sentinel lymph node biopsy: pooled analysis using data from a systematic review and two institutions[J]. Front Oncol, 2020, 10: 518568.
[40] PORT E R, GARCIA-ETIENNE C A, PARK J, et al. Reoperative sentinel lymph node biopsy: a new frontier in the management of ipsilateral breast tumor recurrence[J]. Ann Surg Oncol, 2007, 14(8): 2209-2214.
[41] SCHRENK P, TAUSCH C, WAYAND W. Lymphatic mapping in patients with primary or recurrent breast cancer following previous axillary surgery[J]. Eur J Surg Oncol, 2008, 34(8): 851-856.
[42] MAASKANT-BRAAT A J, ROUMEN R M, VOOGD A C, et al. Sentinel node and recurrent breast cancer (SNARB): results of a nationwide registration study[J]. Ann Surg Oncol, 2013, 20(2): 620-626.
[43] JACKSON B M, KIM S, DAVIDSON R, et al. Repeat operative sentinel lymph node biopsy[J]. Clin Breast Cancer, 2006, 6(6): 530-532.
[44] VUGTS G, MAASKANT-BRAAT A J, VOOGD A C, et al. Improving the success rate of repeat sentinel node biopsy in recurrent breast cancer[J]. Ann Surg Oncol, 2015, 22(suppl 3): S529-S535.
[45] GURU S D, HOSKIN T L, WHALEY D H, et al. Repeat sentinel lymph node surgery in recurrent breast cancer: peritumoral vs periareolar injections[J]. Clin Breast Cancer, 2021, 21(5): 466-476.
[46] VICINI E, LEONARDI M C, FONTANA S K R, et al. How to perform repeat sentinel node biopsy safely after a previous mastectomy: technical features and oncologic outcomes[J]. Ann Surg Oncol, 2022, 29(3): 1750-1760.
[47] POODT I G M, VUGTS G, MAASKANT-BRAAT A J G, et al. Risk of regional recurrence after negative repeat sentinel lymph node biopsy in patients with ipsilateral breast tumor recurrence[J]. Ann Surg Oncol, 2018, 25(5): 1312-1321.
[48] 中国抗癌协会. 乳腺癌前哨淋巴结活检规范化操作指南(2022精要版)[J]. 中国肿瘤临床, 2022, 49(22): 1135-1142.
China Anti-Cancer Association. Guidelines for standardized practice of sentinel lymph node biopsy in breast cancer (2022 abridged version) [J]. Chin J Clin Oncol, 2022, 49(22): 1136-1142.
[49] VOOGD A C, VAN OOST F J, RUTGERS E J, et al. Long-term prognosis of patients with local recurrence after conservative surgery and radiotherapy for early breast cancer[J]. Eur J Cancer, 2005, 41(17): 2637-2644.
[50] POODT I G M, VUGTS G, SCHIPPER R J, et al. Prognostic impact of repeat sentinel lymph node biopsy in patients with ipsilateral breast tumour recurrence[J]. Br J Surg, 2019, 106(5): 574-585.
[51] AEBI S, GELBER S, ANDERSON S J, et al. Chemotherapy for isolated locoregional recurrence of breast cancer (CALOR): a randomised trial[J]. Lancet Oncol, 2014, 15(2): 156-163.
[52] LEE J H, LEE S K, PARK S M, et al. Independent prognostic factors for overall survival after salvage operation for ipsilateral breast tumor recurrence following breast-conserving surgery[J]. J Breast Cancer, 2015, 18(4): 386-393.
[53] VOOGD A C, VAN TIENHOVEN G, PETERSE H L, et al. Local recurrence after breast conservation therapy for early stage breast carcinoma: detection, treatment, and outcome in 266 patients. Dutch study group on local recurrence after breast conservation (BORST)[J]. Cancer, 1999, 85(2): 437-446.
[54] UGRAS S, MATSEN C, EATON A, et al. Reoperative sentinel lymph node biopsy is feasible for locally recurrent breast cancer, but is it worthwhile? [J]. Ann Surg Oncol, 2016, 23(3): 744-748.
[55] ALPERT T E, KUERER H M, ARTHUR D W, et al. Ipsilateral breast tumor recurrence after breast conservation therapy: outcomes of salvage mastectomy vs salvage breast-conserving surgery and prognostic factors for salvage breast preservation[J]. Int J Radiat Oncol Biol Phys, 2005, 63(3): 845-851.
[56] GROHEUX D, COCHET A, HUMBERT O, et al. 18F-FDG PET/CT for staging and restaging of breast cancer[J]. J Nucl Med, 2016, 57(suppl 1): 17-26.
[57] KRAMMER J, SCHNITZER A, KAISER C G, et al. 18F-FDG PET/CT for initial staging in breast cancer patients-is there a relevant impact on treatment planning compared to conventional staging modalities?[J]. Eur Radiol, 2015, 25(8): 2460-2469.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












乳腺癌的手术发展经历了从“巨创”到“微创”的重大转变。1894年Halsted[1]首次提出了根治性乳房切除术,后人在此基础上进一步提出了扩大根治术以求最大程度地控制病灶。20世纪中后期,保乳治疗应运而生,旨在最大程度地控制病灶,同时仅对患者造成最小程度的伤害。迄今为止,多项随机对照临床试验的长期随访(>20年)结果显示,保乳手术与乳房切除术的总体预后相当
78