中国医科院王朝辉研究员/北大张强教授《Nano Letters》:富锰过氧化锌功能纳米颗粒用于增强癌症免疫治疗
2023-11-10 BioMed科技 BioMed科技 发表于上海
研究阐明了功能性纳米颗粒放大STING免疫刺激作用的可行性,为肿瘤免疫治疗提供了新的思路。
与手术、化疗和放疗等直接靶向肿瘤细胞的传统疗法不同,免疫疗法是一种利用免疫系统来对抗肿瘤的新兴治疗手段。近年来,肿瘤免疫疗法取得了显著的进展,然而,免疫系统刺激不足会严重阻碍癌症免疫效果,导致疗效欠佳和响应率低。激活环GMP-AMP合成酶(cGAS)-干扰素基因刺激器(stimulator of interferon genes ,STING)通路可产生大量Ⅰ型干扰素(IFNs),在激活先天性免疫反应和获得性免疫反应中发挥关键作用,具有巨大的抗肿瘤潜力。然而,目前的STING激动剂体内分布缺乏特异性、稳定性差和代谢快、安全剂量难以控制等问题,制约了其治疗作用的发挥。因此,亟需发展肿瘤特异性的治疗策略,通过增强STING通路提高抗肿瘤免疫治疗效果。
为此,中国医学科学院药物研究所的王朝辉研究员和北京大学的张强教授在Nano Letters发表了题为“Manganese-Enriched Zinc Peroxide Functional Nanoparticles for Potentiating Cancer Immunotherapy”的文章,阐明了功能性纳米颗粒放大STING免疫刺激作用的可行性,为肿瘤免疫治疗提供了新的思路。

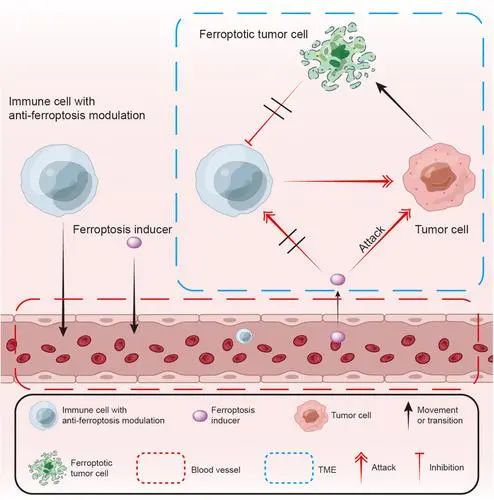
该研究通过构建了肿瘤微环境 (TME) 响应的富锰过氧化锌纳米颗粒 (MONP),诱导癌细胞的免疫原性死亡(ICD)和激活干扰素基因(STING)通路的刺激因子协同发挥肿瘤免疫治疗作用。MONPs在暴露于酸性肿瘤组织时尤其会解离,并在原位产生•OH以产生ICD效应。此外,Mn+激活STING并协同诱导I型干扰素和炎性细胞因子的分泌,以实现特异性的T细胞反应。同时,MONPs通过减少Tregs并将M2巨噬细胞极化为M1型来释放级联适应性免疫反应,从而缓解TME的免疫抑制。同时,MONPs与抗PD-1抗体联合使用,在抑制肿瘤生长和预防肺转移方面显示出优越的疗效。
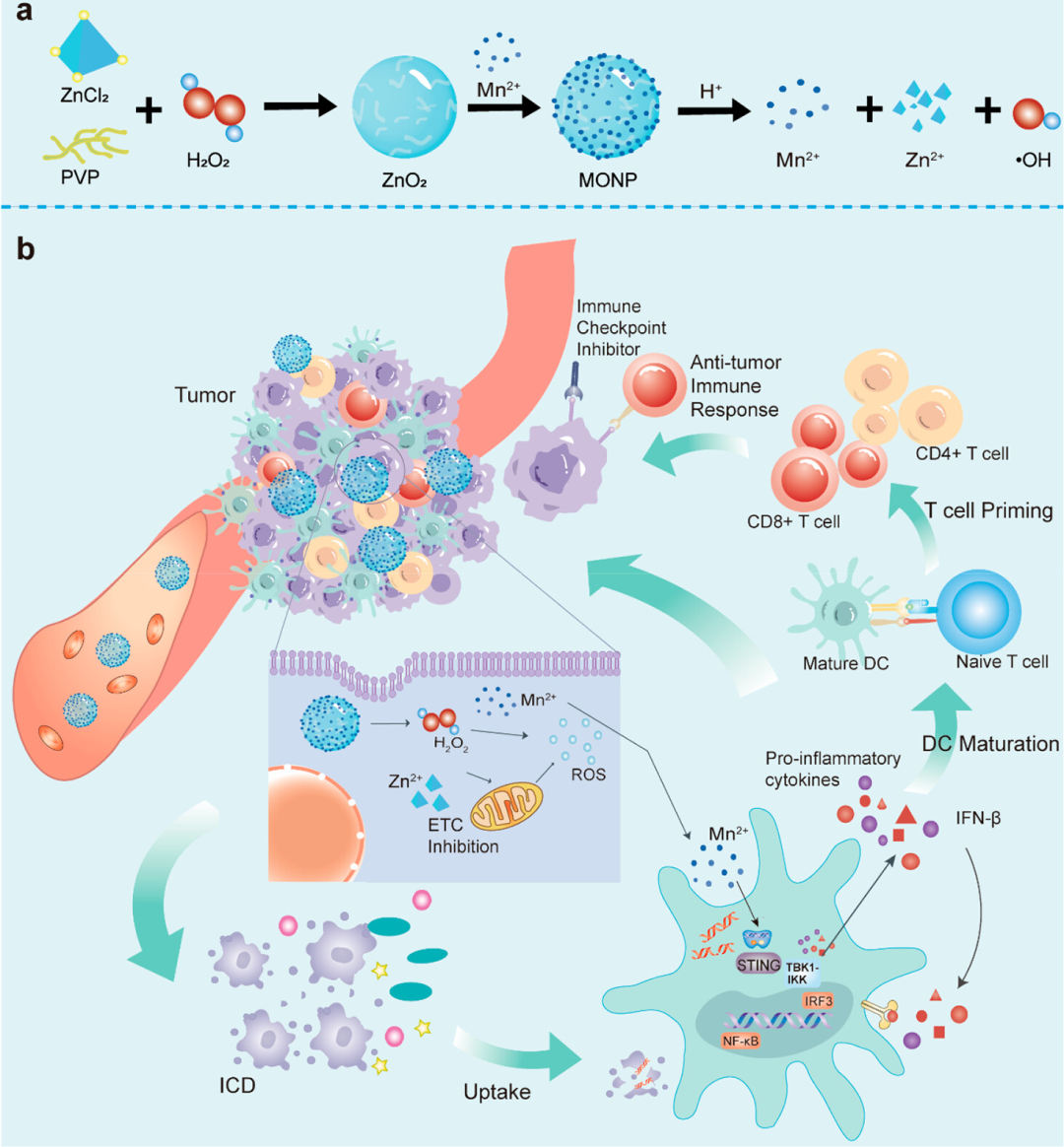
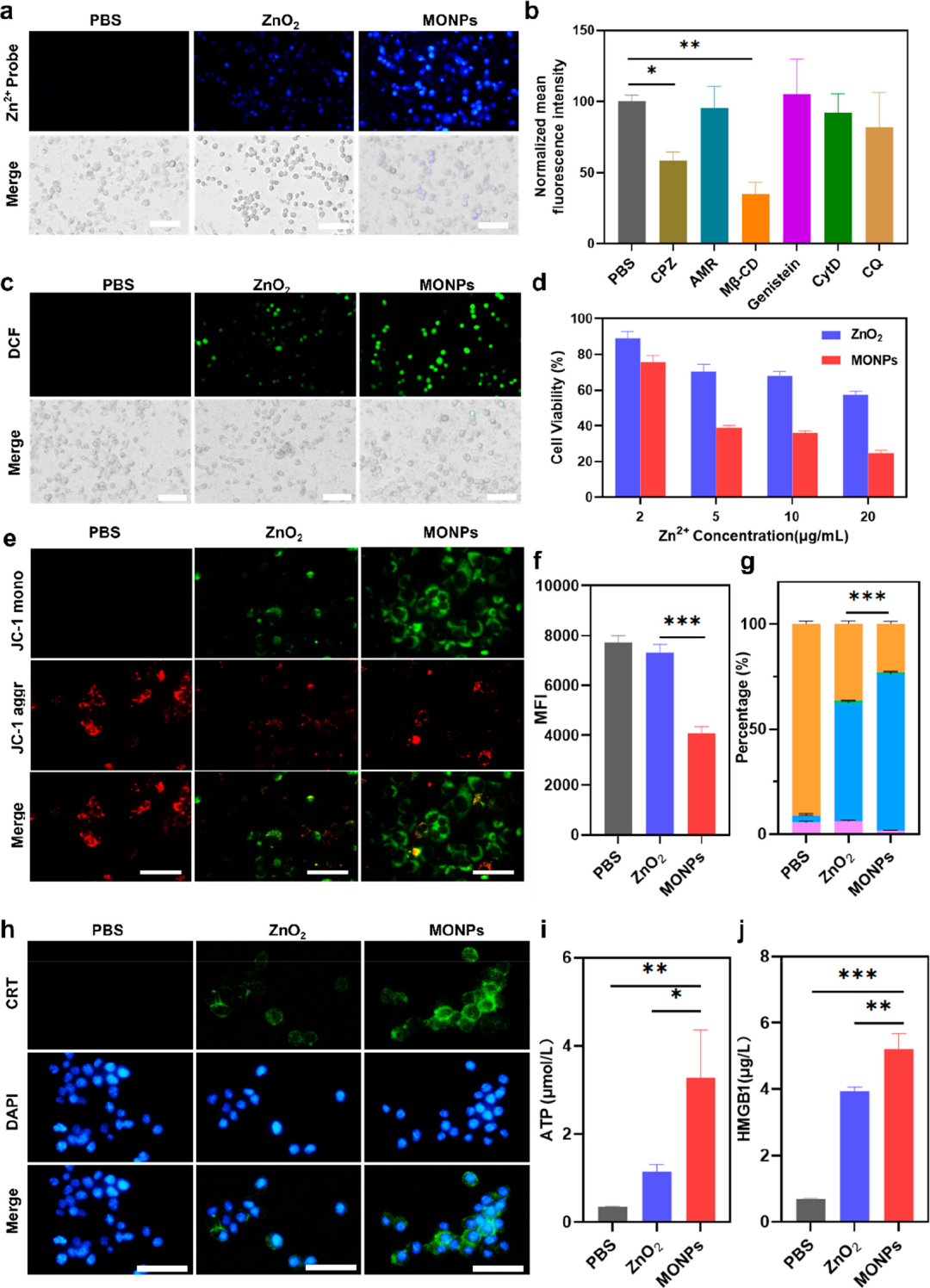
作者研究了 MONPs 在 4T1 细胞中的胞内递送和抗肿瘤作用。MONPs产生大量的ROS,触发肿瘤细胞的ICD作用,伴有CRT的表面易位,释放HMGB1和三磷酸腺苷ATP等信号分子,进而引发高效的抗肿瘤免疫反应。
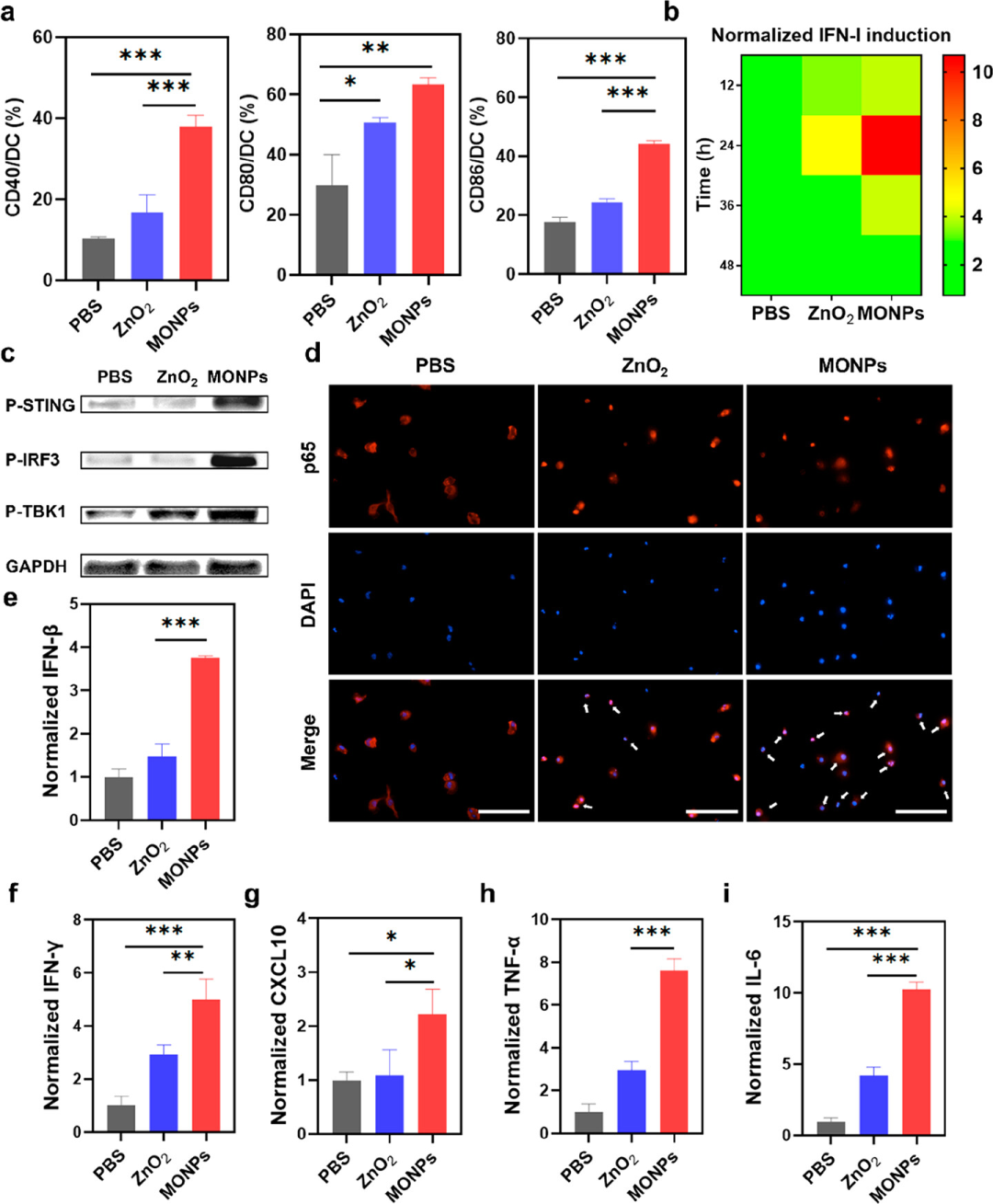
ICD效应中释放的DAMPs与树突状细胞(DC)表面的模式识别受体结合,激活先天性和适应性免疫。为了评估对DC的刺激,作者收集了 BMDC 并与 MONP 共培养。结果显示MONPs能够显着上调共刺激分子 CD40、CD80 和 CD86 的表达,有效诱导DC 的活化和成熟。同时,通过检测 RAW-Lucia ISG报告细胞表达的STING、cGAS-STING相关蛋白表达和IFN-β、IFN-γ、CXCL10、TNF-α、IL-6等促炎因子,验证了Mn2+能够有效激活cGAS-STING通路,与ICD效应协同进而引发更高效的免疫反应。
在三阴性乳腺癌4T1模型评估了 MONP 的抗肿瘤效果,结果显示MONPs能够显著抑制肿瘤生长(抑制率82.71%),并提高了小鼠的生存时间。与抗PD-1抗体联合使用进一步增强抗肿瘤作用,抑制率为95.47%。值得注意的是,MONPs对肺转移表现出明显的抑制作用。

作者接下来深入探讨了抗肿瘤免疫反应。通过冰冻切片的免疫荧光验证肿瘤中的STING激活,并在MONPs刺激下观察到STING蛋白的磷酸化表达。
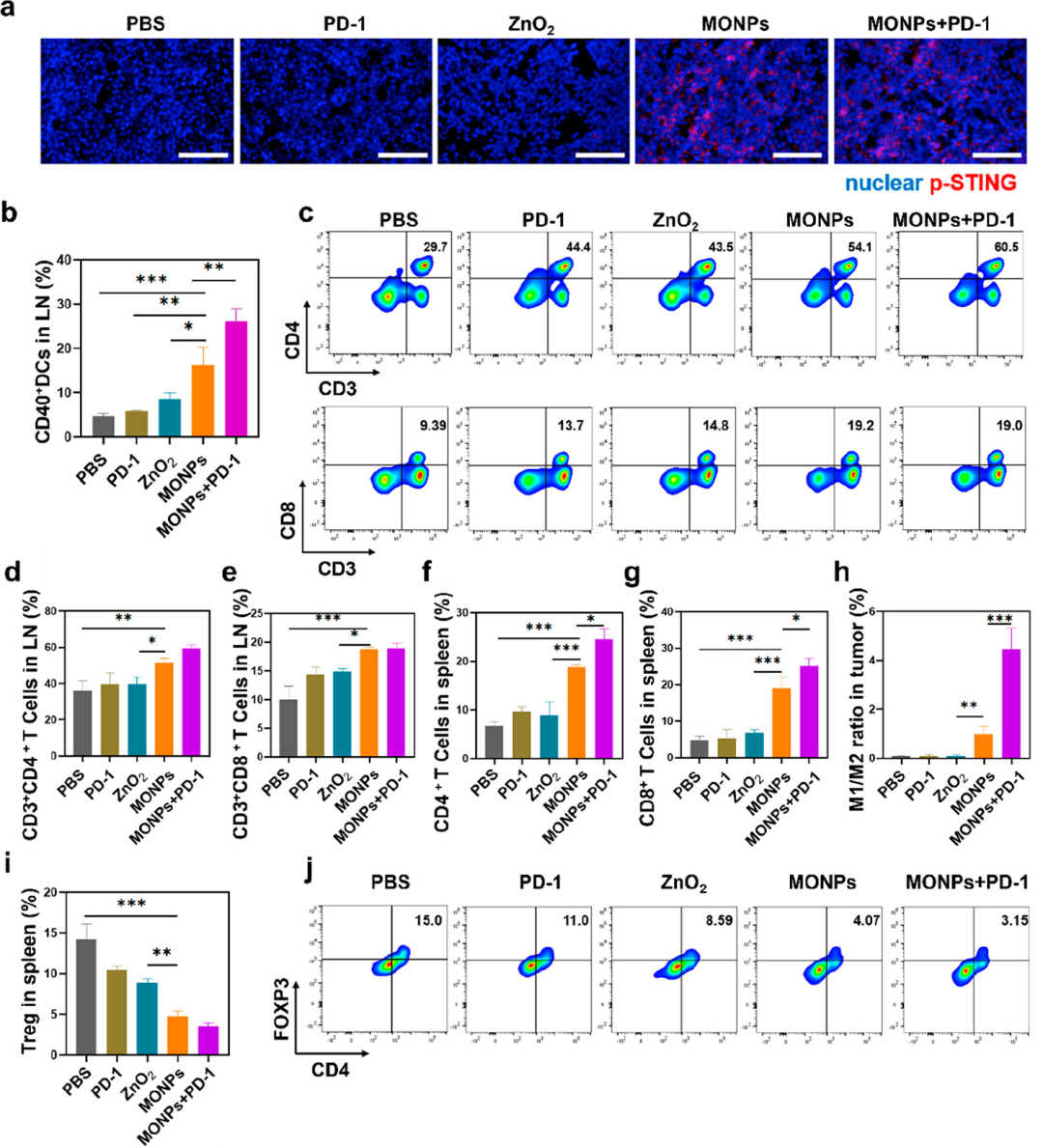
总体而言,这项工作证明了功能性纳米颗粒可以诱导ICD、放大STING先天免疫刺激,以实现强大的抗肿瘤免疫治疗作用,为新型肿瘤免疫治疗策略的开发提供了参考。
原文链接:
https://doi.org/10.1021/acs.nanolett.3c02941
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言