椎基底动脉扩张延长症与后循环脑梗死
2016-08-27 王雪 赵仁亮 神经科空间
椎基底动脉扩张延长症(vertebrobasilar dolichoectasia,VBD)是一种以基底动脉或椎动脉颅内段显著扩张、延长和迂曲为特征的脑血管病变。近年来研究显示,VBD是后循环脑梗死的独立危险因素,而且由VBD导致的后循环脑梗死患者的二级预防疗效不佳,脑卒中复发率较高[1]。目前,关于VBD及其导致后循环脑梗死病理生理机制的研究不断深入,本文就近年来相关研究进展综述如下。一、V
椎基底动脉扩张延长症(vertebrobasilar dolichoectasia,VBD)是一种以基底动脉或椎动脉颅内段显著扩张、延长和迂曲为特征的脑血管病变。近年来研究显示,VBD是后循环脑梗死的独立危险因素,而且由VBD导致的后循环脑梗死患者的二级预防疗效不佳,脑卒中复发率较高[1]。目前,关于VBD及其导致后循环脑梗死病理生理机制的研究不断深入,本文就近年来相关研究进展综述如下。
一、VBD的流行病学
VBD在临床中并非少见,尤其是在脑卒中患者中。在美国一家三级转诊医院的脑MRI/MRA数据库中,1440名患者中有64名符合VBD的诊断标准,约占4.4%,这些VBD患者不合并后循环血管的明显狭窄或闭塞[2]。Nakamura等[3]在日本481例急性脑卒中患者的MRA中发现了37例VBD, VBD在缺血性脑卒中患者中的患病率为6.4%,在出血性脑卒中患者中为12.1%;另外,男性VBD患者的比例更高。也有报道称,在缺血性脑卒中短暂性脑缺血发作(TIA)患者中,VBD的患病率可高达13.2%[4]。
研究表明,VBD是后循环脑梗死的独立危险因素。Passero等[5]对有或无并发后循环脑梗死的2组VBD患者进行比较后发现,血管扩张延长的严重程度能促使VBD患者发生脑卒中,而且在某些脑卒中患者是唯一可能的因素,提示VBD与后循环脑梗死独立相关。Ubogu和Zaidat[2]对45名VBD患者及性别、年龄匹配的对照组进行4~7年的随访研究,把后循环脑缺血作为主要临床终点,结果显示VBD组患者的后循环脑缺血发生比例明显高于对照组(22例 vs. 2例,P=0.000),从而证实VBD是后循环脑梗死的独立危险因素。在对156名VBD患者平均随访11.7年的队列研究发现,有48%的患者发生脑卒中,其中缺血性脑卒中占3/4,并且98%的发生于椎基底动脉系统供血区[1]。最近,Wolter等[6]入选9个队列的375名VBD患者进行Meta分析发现,后循环脑梗死的5年发病率为17.6%,远高于脑干或颅神经的压迫症状、脑出血、脑积水等其他VBD相关临床表现的发病率。
二、VBD的病因及病理
目前,VBD的病因仍不清楚,它的发病危险因素也尚无一致结论。Ubogu和Zaidat[2]对45例VBD患者与年龄、性别匹配的对照组比较后发现,2组在高血压、吸烟、高脂血症、糖尿病等血管危险因素的分布上比较均衡,提示VBD可能是一种先天性的、涉及动脉壁弹力层的血管病变。而另一对照研究却未得出一致的结论,研究人员发现在一组年龄分布在50~70岁的健康查体人群中,无症状性VBD患者多种心血管病危险因素的发生率显著增高,如高血压、肥胖、高血脂、糖尿病及心血管病家族史等,这些危险因素可能会促进VBD相关脑卒中的发生及复发[7]。另外,对于缺血性脑卒中患者,有研究显示,VBD组患者的吸烟率更高,其他血管危险因素在2组间无明显差异[3]。上述研究结论的不一致可能源于方法学、研究人群及样本量的差异。
近年来,多项研究探索了颅内动脉扩张延长症(intracranial arterial dolichoectasia,IADE)的病理改变。组织学研究显示,IADE的病理变化为:内弹力层退化、弹性内膜裂隙增多、中膜因缺乏网状纤维变薄以及平滑肌萎缩,有时弹性组织严重退化及滋养血管增加可使内膜增厚,在血管扩张延长处,动脉外径异常增大、动脉壁变薄、血栓形成[8]。提示IADE是颅内动脉中膜的病变,与动脉粥样硬化性病变不同,后者主要累及动脉壁的内膜和内皮层。但VBD患者基底动脉的粥样硬化性斑块更多见,这可能是由于动脉扩张、迂曲引起的血液流变学变化所致[9,10]。另外,IADE也可能是系统性血管扩张性疾病的一部分,并不只局限于脑的供血动脉。研究证明,IADE患者的胸主动脉直径比无扩张延长者的更大[11],VBD患者可合并冠状动脉的扩张延长,基底动脉直径增加可能是心血管事件的独立预测因子[12,13]。
三、VBD的诊断标准
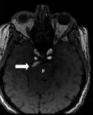
目前,VBD的诊断主要依靠CT/CTA和MRI/MRA等影像学检查方法,不同检查方法的诊断标准也不尽相同。VBD的定义包括动脉的扩张和延长两个方面,其诊断标准也要求同时满足这2个条件。Smoker等[14]提出的CT/CTA的VBD诊断标准中,将基底动脉直径≥4.5 mm诊断为扩张,这一标准被逐渐接受并用于MRI/MRA。后来,Passero和Rossi[1]补充了椎动脉颅内段扩张的标准,即直径≥ 4.0 mm。基底动脉的延长可以表现为动脉分叉处较高或动脉在走形中向一侧偏移。在CT/CTA中,基底动脉的分叉高度和偏移度根据解剖标志被分别划分为4个等级:0级,在鞍背或鞍背下方;1级,在鞍上池水平;2级,在第三脑室水平;3级,压迫或超过第三脑室。偏移度:0级,在中线上;1级,偏移但不超过斜坡或鞍背的边缘;2级,偏移超过斜坡或鞍背的边缘;3级,偏移至桥小脑角池[14]。由于MRI对骨性标志显示不佳,因此偏移度是分级标准稍有变化,0级为在中线上,1级为可能偏离中线,2级为明显偏离中线,3级为偏移至桥小脑角[15]。这2种分级标准都将分叉高度或偏移度≥2级诊断为延长。Ubogu和Zaidat[2]提出了TOF-MRA中动脉延长的诊断标准:基底动脉长度≥29.5 mm或横向偏移≥10 mm,椎动脉颅内段任意一支长度≥23.5 mm或横向偏移≥10 mm。上述诊断标准在临床及研究中已广泛应用。
目前,鲜有研究比较CT/CTA和MRI/MRA这2种影像学方法诊断VBD的准确性。最近,研究人员对CTA和TOF-MRA诊断VBD的结果进行比较后发现,在评价基底动脉直径和分叉高度时两者具有很好的一致性,而TOF-MRA对偏移度的评估测试者间信度较低;总体而言,两者诊断VBD的准确性基本一致[16]。另外,他们还发现,CT/CTA对血管周围钙化比较敏感,MRI则可以更好地显示脑干灶周水肿,因此,对VBD患者同时行CT/CTA和MRI/MRA可以获得更大的诊断价值[16]。
四、VBD导致后循环脑梗死的发病机制
后循环脑梗死是VBD患者最常见的临床表现和最主要的死亡原因。VBD导致后循环脑梗死的可能机制包括:血流动力学异常、原位血栓形成导致血管闭塞、穿支动脉病变,或是这些机制的联合作用。
1.血流动力学异常:
VBD患者后循环血管扩张处的血流通常是双向的,逆行的血流会导致前向血流的减少和血流速度的下降。对VBD患者行经颅多普勒超声检查发现,其椎基底动脉系统收缩期峰值血流速度及峰值平均速度都低于正常平均值的下限,而舒张期血流峰值速度相对无明显下降[17]。MRI-FLAIR序列的血管高信号征(flair vascular hyperintency,FVH)往往提示此处血管内血流速度下降。最近,Forster等[18]发现在77名VBD患者中,大约64%的患者可见不同程度的基底动脉FVH,而且严重的FVH更常见于表现为后循环脑梗死/TIA的VBD患者。韩金涛等[19]通过计算流体力学方法模拟VBD患者椎基底动脉的血流动力学变化过程,利用动脉血流流线图观察血液在血管内流动的轨迹及速度,发现血流在基底动脉入口处及扭曲部小弯侧速度较低。基底动脉严重扩张造成的血流速度下降及灌注不足更容易引起大脑后动脉供血区的脑梗死,且这些患者大约半数合并前循环的闭塞或严重狭窄,不能为后循环提供有效的一级侧支代偿[20]。另外,VBD血管走形迂曲及血流动力学改变使血管壁更常合并动脉粥样硬化性改变,导致后循环缺血[5,20]。
2.原位血栓形成:
VBD血管扩张处血流速度下降引起的血流停滞及湍流会导致反复的血栓形成,造成血管的狭窄或闭塞。有研究显示,在VBD患者的脑MRI/MRA和CTA上都能发现腔内附壁血栓,这些血栓可闭塞血管、堵塞穿支动脉的开口或脱落成为栓子,造成脑梗死[16]。另外,反复的腔内出血及血栓形成可使小的无症状的梭形动脉瘤快速进展为有症状的扩张延长性动脉瘤[5,20]。
3.穿支动脉病变:
VBD患者血管迂曲、成角产生的机械牵拉作用可使动脉分支变形,并使其血流灌注减少,基底动脉的穿支最容易被拉伸、扭曲,造成脑桥的基底动脉供血区梗死[5],梗死灶多位于基底动脉偏移位置的对侧[20]。Pico等[21]发现IADE与脑小血管病独立相关,腔隙性脑梗死,多发腔梗、严重的白质脱髓鞘和血管周围间隙扩大等脑小血管病的影像学表现在IADE患者中显著增多。病理学研究显示,IADE患者脑小血管病变的发生率大约为对照组的4倍,主要是直径<300 μm的小动脉硬化和透明样变,IADE和脑小血管病都是动脉中膜的病变,研究者认为它们的发病可能都与细胞外基质金属蛋白酶的代谢相关[10]。最近,在针对腔隙性脑梗死患者二级预防的大型临床研究中,将纳入的2612名患者分为椎基底动脉扩张组和非椎基底动脉扩张组,对其临床结局进行随访观察,发现椎基底动脉扩张组患者死亡率较高,差别具有统计学意义,提示椎基底动脉扩张可能与腔隙性脑梗死患者的不良预后有关[22]。
五、VBD相关后循环脑梗死的影像学特征
多个研究显示,VBD患者的梗死部位主要在脑桥,发生率大约为非VBD患者的3倍[3]。Passero和Filosomi[5]分析了40例发生后循环脑梗死的VBD患者,发现超过半数(24/40)为幕下性梗死,其中脑桥梗死14例、小脑梗死5例、中脑梗死4例以及延髓梗死1例,而脑桥梗死者的梗死灶主要位于脑桥中部(9/14),另外16名患者则为幕上性梗死,丘脑和大脑后动脉皮质支供血区各有8例。Kumral等[20]也发现在29名发生后循环脑梗死的VBD患者中,51%的梗死灶位于脑桥。为研究基底动脉扩张延长所致脑桥梗死的形式,Kwon等[23]将96名无椎基底动脉狭窄的孤立性脑桥梗死患者分为脑桥旁正中梗死组和脑桥腔隙性梗死组,通过对2组患者基底动脉直径、偏移度和分叉高度进行比较,发现基底动脉扩张更常见于脑桥旁正中梗死的患者(31.4%vs.11.5% ;P= 0.016),其OR值为5.80(95%CI: 1.66~20.21)。
六、治疗及预后
目前尚无针对VBD特异性治疗的相关报道,对于VBD相关后循环脑梗死患者,仍采用常规的脑卒中评估管理及治疗方式。但最近有研究显示,脑微出血在VBD患者的发生率更高、数量更多,而脑微出血可增加急性脑卒中患者血管重建后的出血风险,因此研究人员建议,对于CT提示为VBD的急性脑卒中患者,在溶栓治疗前应该行MRI检查以评估脑微出血的严重程度,谨慎实施溶栓治疗[4]。
多项研究显示VBD相关后循环脑梗死的二级预防效果不佳,这可能是由于其存在多种不同的发病机制,而抗凝或抗血小板聚集等常规脑卒中二级预防措施并不能作用于上述所有发病机制。Passero和Rossi[1]对156名VBD患者随访11.7年,发现尽管他们采用了抗凝或抗血小板聚集治疗,脑卒中患者10年内复发率仍达到56%,明显高于同时期关于普通人群的报道(29%~43%)。黄晓东等[24]认为,在VBD并发缺血性脑卒中患者的二级预防中,华法林抗凝治疗的效果优于抗血小板聚集治疗,且出血等不良事件无明显差异。但此为小样本临床研究,对于VBD患者所采取的不同治疗措施,迫切需要大样本的随机对照试验来评价其疗效和安全性,以指导临床治疗。
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言







#扩张#
70
VBD是不是等于梭形动脉瘤?
79
好文,从这里学习了好多新知识,新信息。赞了!
91
很好,不错,以后会多学习
76
很好,不错,以后会多学习
71
#脑梗#
63
#基底动脉#
55
学习啦,谢谢分享
80