Genes & Diseases:向廷秀教授团队新研究揭示锌指蛋白382在乳腺癌进展中的关键作用
2024-04-29 Genes and Diseases Genes and Diseases 发表于陕西省
该研究重点研究了ZNF38在体内外乳腺癌症中的作用和机制,揭示了其可能是乳腺癌症治疗的潜在靶点。

乳腺癌是全球女性最常见的恶性肿瘤之一,且发病率逐年上升。虽然在综合治疗及新药研发方面不断发展,但乳腺癌的分子靶向治疗仍然非常有限。因此,寻找新的有效生物标志物并了解其分子机制仍然至关重要。锌指蛋白382(ZNF382)是拥有KRAB结构域的锌指蛋白家族成员,在各类肿瘤中出现启动子区域甲基化异常和表达下调的现象。然而,ZNF382在乳腺癌中的详细作用和机制尚不明确。
重庆大学附属肿瘤医院向廷秀教授团队在本刊发表题为“Zinc-finger protein 382 antagonises CDC25A and ZEB1 signaling pathway in breast cancer”的研究论文,重点研究了ZNF38在体内外乳腺癌症中的作用和机制,揭示了其可能是乳腺癌症治疗的潜在靶点。
1. ZNF382的表达在乳腺癌中下调
研究发现ZNF382的蛋白质水平在乳腺癌组织中下调(图1A)。根据其病理特征,这些样本被分为luminal型组和基底型组。qPCR结果显示ZNF382 mRNA水平在基底型中表达相对较低,而luminal型中的ZNF382 mRNA水平和癌旁组织之间没有显著差异(图1B)。ZNF382的高表达能显著延长患者的生存时间(图1C)。在乳腺癌组织中ZNF382的下调与启动子DNA甲基化有关,提示ZNF382可能是乳腺癌的独立预后因素。
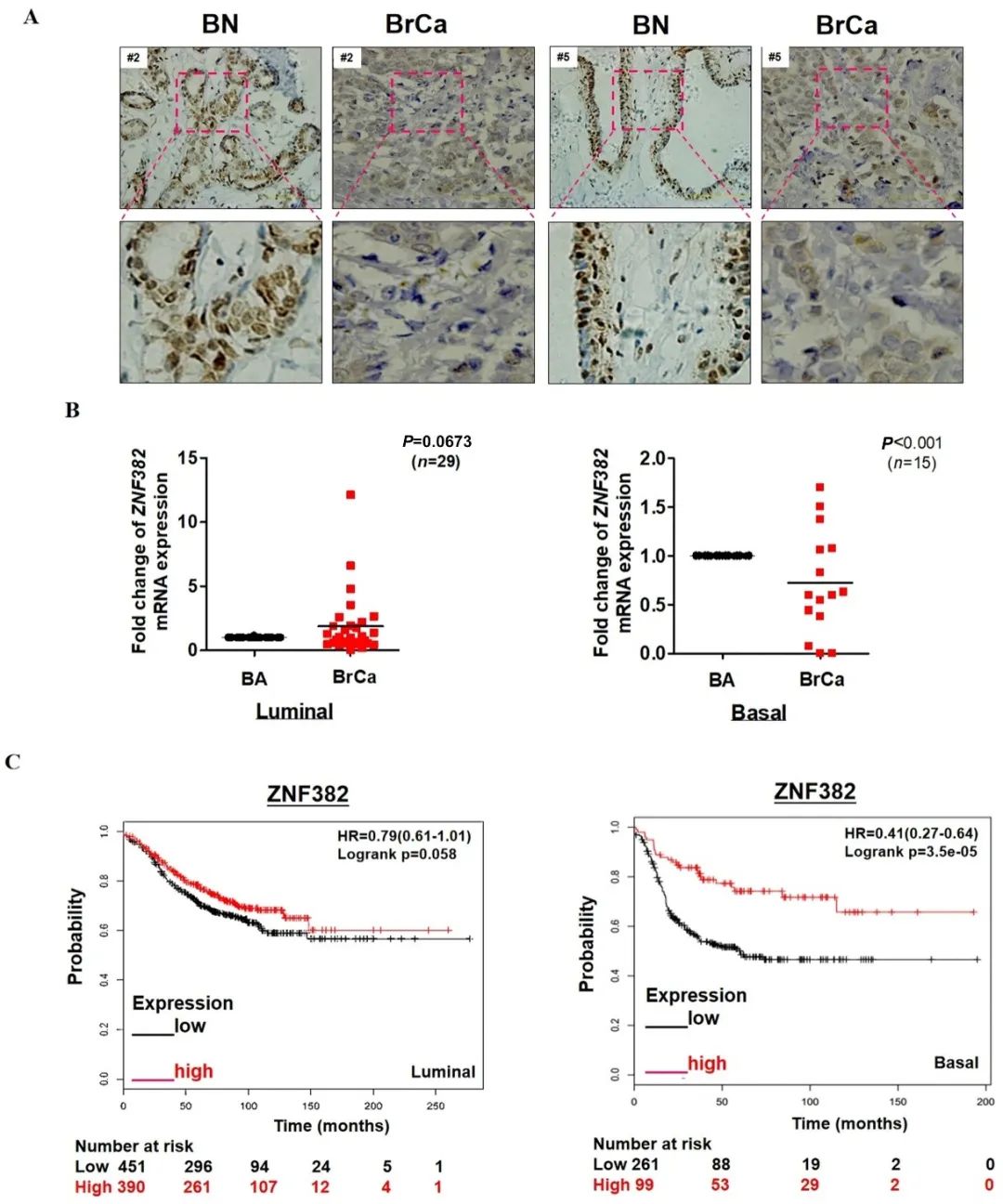
图1 ZNF382在乳腺癌组织中表达下调
2. ZNF382过表达对乳腺癌细胞的影响
ZNF382的过表达能抑制乳腺癌细胞的增殖和集落形成,并在乳腺癌细胞中诱导G0/G1期的细胞周期阻滞和凋亡,而抑制则促进细胞生长(图2)。
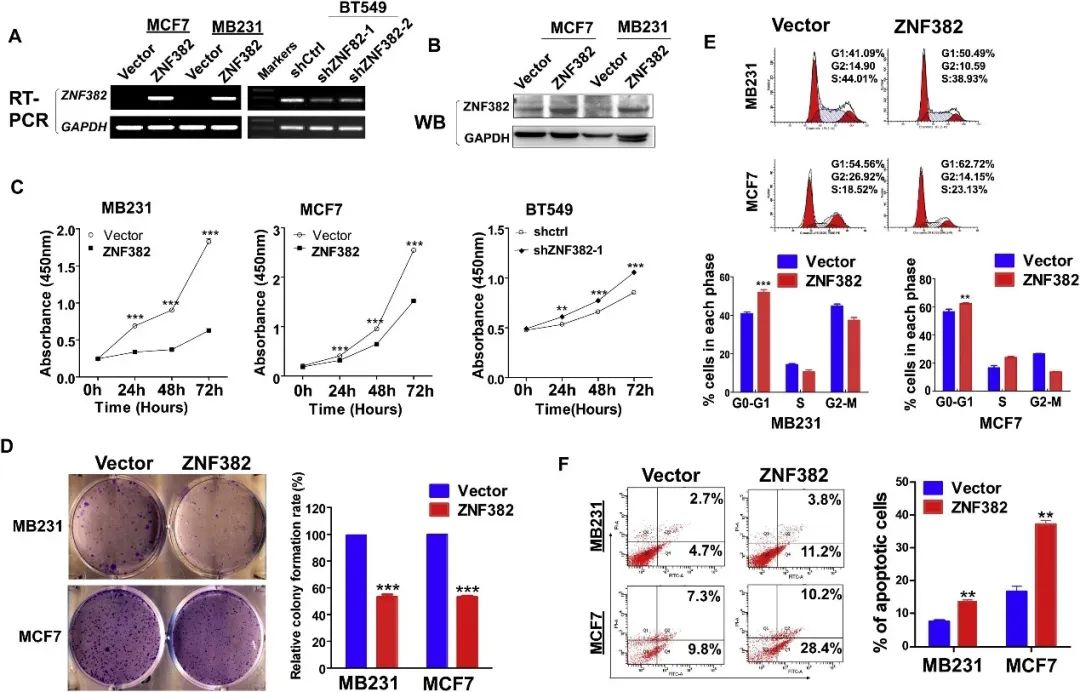
图2 ZNF382抑制乳腺癌细胞增殖并诱导G2/M期细胞周期停滞和凋亡
ZNF382过表达抑制乳腺癌细胞的创伤愈合、细胞迁移和侵袭。相反,ZNF382的抑制增强了乳腺癌细胞的迁移能力(图3)。
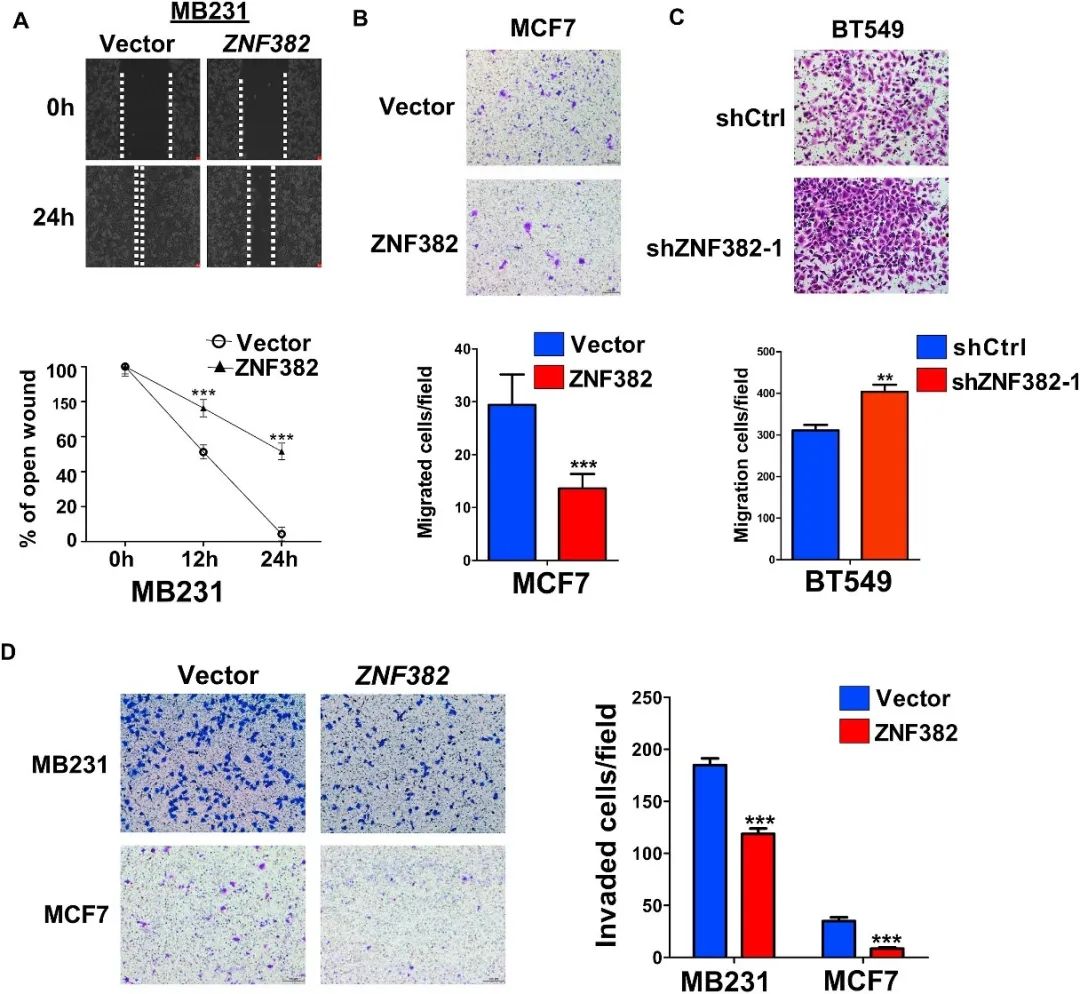
图3 ZNF382抑制乳腺癌细胞的迁移和侵袭
3. ZNF382可以调控上皮间充质转化(EMT)
研究发现ZNF382负调控乳腺癌细胞中ZEB1和SNAIL的表达,并影响上皮标志物(E-cadherin和Occludin)和间质标志物(Vimentin、N-Cadherin和Slug)的表达(图4)。
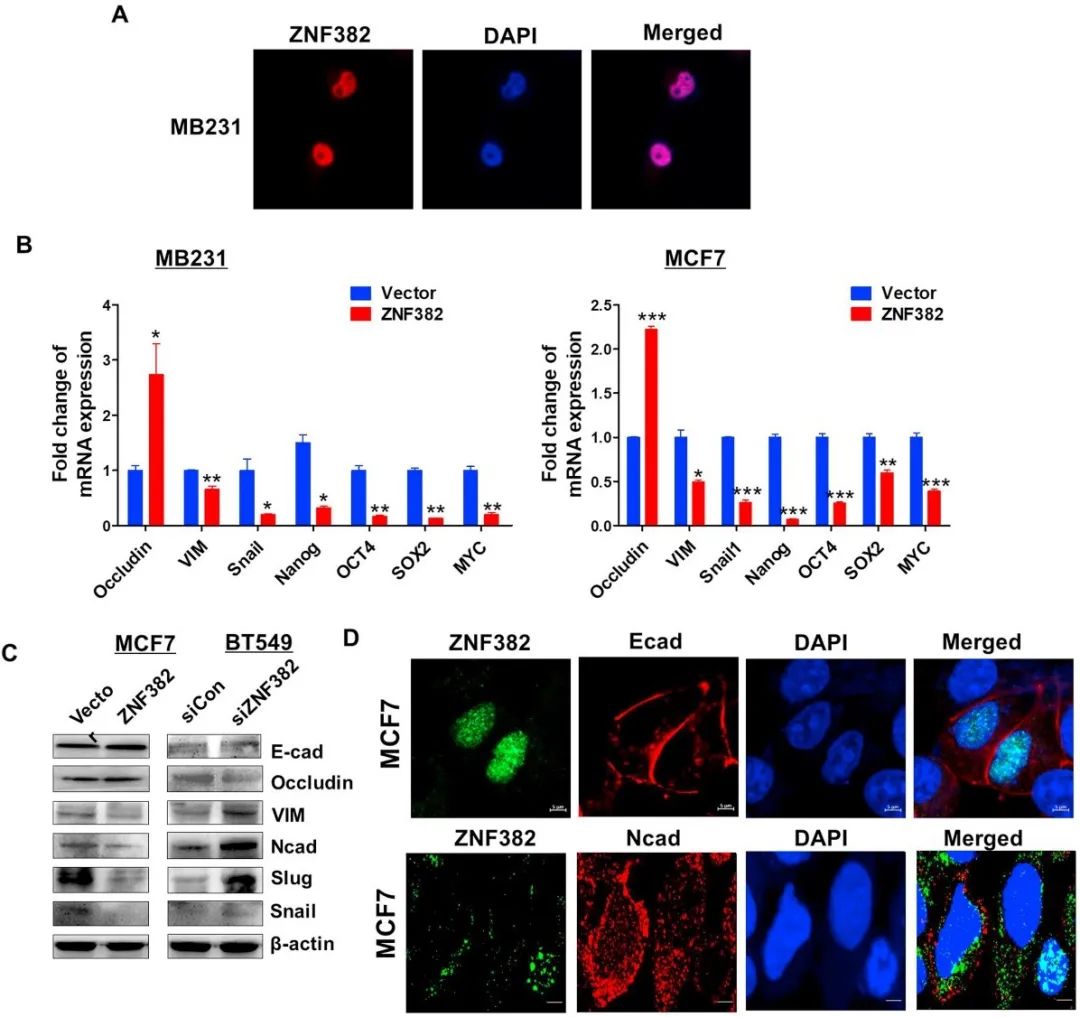
图4 ZNF382抑制乳腺肿瘤细胞的EMT通路
4. ZNF382可以通过调节CDC25A诱导G0/G1细胞周期阻滞
研究发现ZNF382过表达显著抑制CDC25A的表达(图5A),而ZNF382干扰则增加了CDC25A的表达(图5B)。乳腺癌细胞中过表达CDC25A部分对抗了ZNF382对细胞周期阻滞的影响(图5C)。进一步的实验证实了ZNF382直接与CDC25A的启动子结合,抑制其活性(图5F、G)。
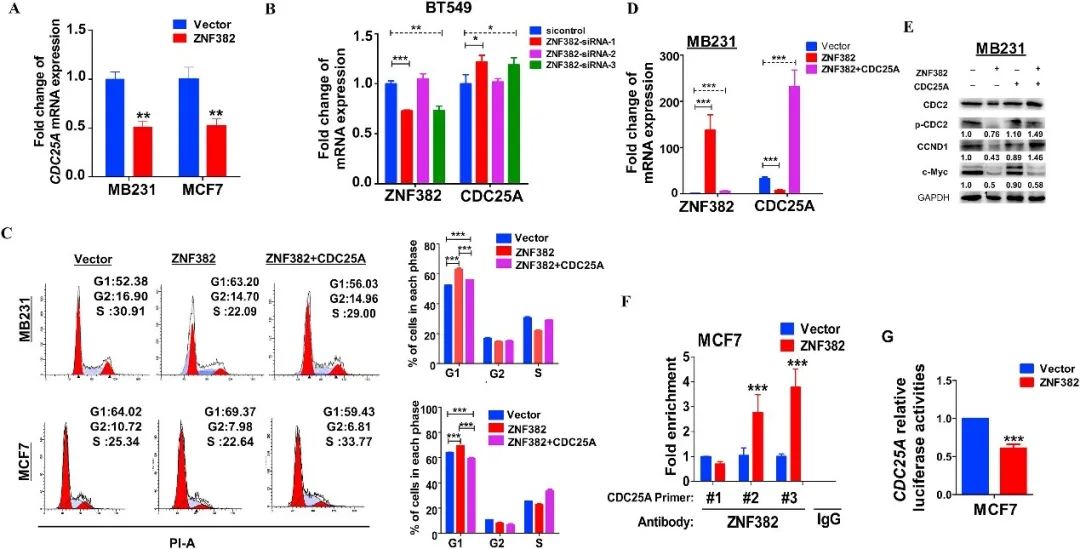
图5 ZNF382通过CDC25A信号通路诱导G0/G1期细胞周期阻滞
5. ZNF382通过直接抑制ZEB1来调节EMT
ZNF382直接与ZEB1的启动子结合,抑制其活性;ZEB1过表达部分拮抗了ZNF382对乳腺癌细胞迁移能力的影响(图6)。
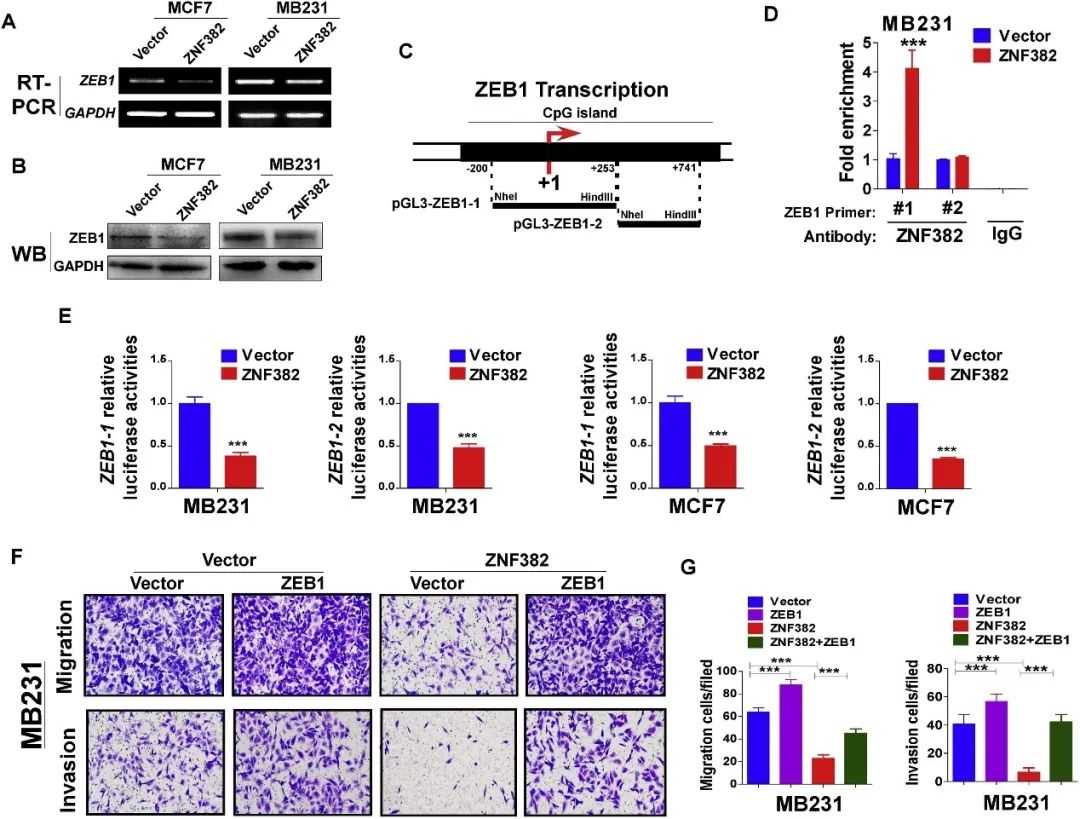
图6 ZNF382通过直接抑制ZEB1来调节EMT
6. ZNF382抑制异种移植瘤的生长
ZNF382的过表达显著抑制了来源于乳腺癌细胞的异种移植瘤的生长。ZNF382下调了CDC25A、Ki-67和Vimentin的表达,上调了E-Cadherin的表达,提示其在体内抑制EMT和细胞增殖的作用 (图7)。
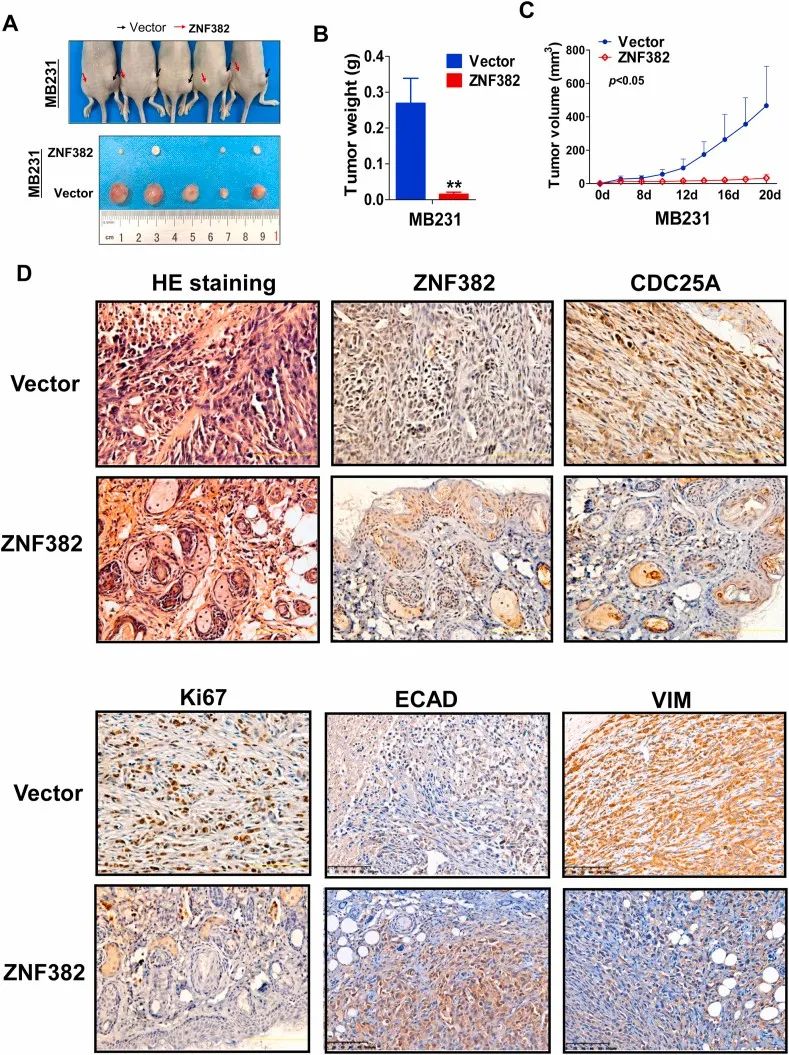
图7 ZNF382抑制裸鼠移植瘤生长
总之,研究结果表明ZNF382的表达在乳腺癌中显著降低,过表达ZNF382起着抑制肿瘤的作用。ZNF382可以通过下调CDC25A来抑制肿瘤细胞增殖,同时通过下调ZEB1来调控EMT进而抑制细胞迁移和侵袭。研究人员认为,ZNF382可能是乳腺癌分子治疗的潜在靶标, ZNF382在乳腺癌中甲基化的机制需要进一步研究来揭示。
文章来源
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S2352304222000137
引用这篇文章:
Li S, He X, Wang Y, et al. Zinc-finger protein 382 antagonises CDC25A and ZEB1 signaling pathway in breast cancer. Genes Dis. 2023;10(2):568-582.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#乳腺癌# #锌指蛋白382#
69