抗体药物偶联物Trodelvy显著改善三阴性乳腺癌患者的PFS:III期研究达到终点
2020-07-07 MedSci原创 MedSci原创
接受Trodelvy治疗的患者中位PFS为5.6个月,而化疗为1.7个月。
Immunomedics宣布其抗体药物偶联物Trodelvy(sacituzumab govitecan-hziy)用于脑转移阴性、先前曾接受过至少两种抗转移疗法的三阴性乳腺癌(TNBC)患者,III期ASCENT研究达到了无进展生存期(PFS)的主要终点。
Trodelvy是一种靶向Trop-2抗原的抗体偶联药物(ADC),Trop-2是一种在许多实体癌中表达的细胞表面蛋白。Trodelvy通过与Trop-2结合,递送抗癌药物SN-38,杀死癌细胞。
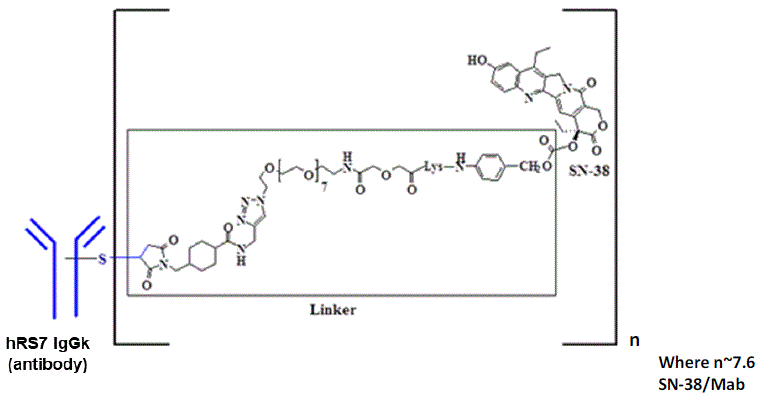
图片来源:https://www.rxlist.com/trodelvy-drug.htm
Trodelvy是由抗乳腺癌细胞高表达的TROP-2单抗和化疗药物(伊立替康)SN-38组成,该抗体药物偶联物已于今年早些时候获得 FDA的加速批准,用于已接受过至少两种疗法的转移性TNBC患者。
Trodelvy的加速批准基于II期研究数据,研究表明Trodelvy客观缓解率为33.3%,缓解时间为7.7个月。
ASCENT研究招募了500多名转移性TNBC患者,他们先前至少接受了两种针对乳腺癌转移的治疗,患者随机接受Trodelvy或医生选择的化疗的治疗,这些患者至少接受过两种转移性疾病的既往疗法。试验结果表明,与化疗相比,Trodelvy将患者疾病进展或死亡风险降低59% (HR=0.41, 95% CI,0.32-0.52)。Trodelvy治疗患者的中位PFS为5.6个月(95%CI,4.3-6.3),化疗为1.7个月(95%CI,1.5-2.6)(p<0.0001)。Trodelvy还达到了研究的关键次要终点,包括总生存期和客观缓解率,完整结果将在即将召开的医学会议上公布。试验中Trodelvy的安全性与FDA批准的标签一致,中性粒细胞减少和腹泻是最常见的3或4级不良事件。
云顶新耀(Everest Medicines)宣布,与Immunomedics公司达成了一项独家许可协议,获得这一创新抗体偶联药物在大中华区、韩国及一些东南亚国家和地区的开发、注册和商业化权益。
日前,中国国家药监局药品审评中心(CDE)最新公示,云顶新耀公司提交的这一抗体偶联药物在中国获批一项临床,适应症为“接受过至少2线既往治疗的转移性三阴性乳腺癌”。

图片来源:CDE官网截图
原始出处:
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#III#
68
#达到终点#
59
#抗体药物#
78
#阴性乳腺癌#
62
#III期研究#
66
#抗体药#
83
学习了
105
#抗体药物偶联物#
71
#PFS#
61
#三阴性#
63