首例“基因剪刀”临床试验获绿灯 美国CRISPR-Cas9人体试验或在年底启动

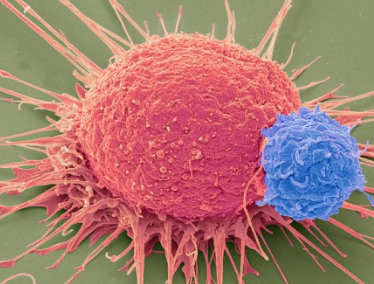
人类T细胞(小)即将在临床试验中经过CRISPR技术修饰,用于靶向抵抗癌细胞(大)。图片来源:STEVE GSCHMEISSNER/SPL
CRISPR,这种风靡生物医学界的基因编辑技术,终于逼近人体临床试验。
6月21日,美国国立卫生研究院(NIH)顾问委员会批准了一项申请,即利用CRISPR-Cas9强化依赖于患者T细胞(一种免疫细胞)的癌症疗法。
“癌症细胞疗法非常具有前景,但绝大多数利用这种疗法的人患的是会复发的病症。”费城宾夕法尼亚大学生理学家、该研究负责人Edward Stadtmauer说。他表示,基因编辑能够增强类似疗法,并剔除它们对癌症以及身体免疫系统的弱点。
首例临床试验规模不大,旨在检测CRISPR是否可在人体中安全使用,而不是它是否能有效治疗癌症。该试验本身并没有预算,而是得到了今年4月由脸谱网前总裁Sean Parker建立的免疫基金的支持。宾夕法尼亚大学将制作基因编辑细胞,并招募及治疗加利福尼亚州和得克萨斯州中心医院的患者。
研究人员将从18名罹患若干种癌症的患者体内去除T细胞,对它们进行3个CRISPR基因编辑。其中之一将会在一种蛋白中插入一个基因,用来侦察癌细胞以及让T细胞靶向它们。第二个编辑是去除可能干扰这一进程的自然T细胞蛋白。第三个基因编辑是防御性的,将会去除识别T细胞的蛋白基因,阻止癌细胞让其失去功能。接下来,研究人员会把这些经过编辑的细胞输入患者体内。
“去年,对CRISPR技术的兴奋就已经可以预期到这一步。”得克萨斯州休斯敦安德森肿瘤中心免疫学家、NIH重组DNA研究咨询委员会(RAC)委员Dean Anthony Lee说,该委员会负责评审这份报告。他表示,CRISPR会让基因组编辑变得更加容易,从而让这种疗法可迅速向前推进。
RAC负责评审在美国进行的包括DNA修饰在内的所有人体临床试验的申请。Stadtmauer的团队现在要做的就是让美国监管者和他们所在机构的评审委员会相信这一技术,并批准相关试验。宾夕法尼亚大学免疫学家、该项目科学顾问Carl June说,临床试验项目可能在今年年末启动。
其他的试验或许也不遥远。例如,马萨诸塞州坎布里奇市的爱迪塔斯生物技术公司已经表示,希望在2017年将CRISPR技术应用于临床,治疗一种罕见的失明症。然而,RAC员工表示,他们尚未接到评审该试验的请求。
CRISPR技术吸引了极大的注意力,是因为它简便易用,然而T细胞试验并非利用基因编辑技术治疗疾病以证明其效能的首例临床试验。2014年,June曾利用一种叫作锌指蛋白核酸的基因编辑技术开展临床试验。
该团队从12名艾滋病患者体内采集了血液样本,去除了在T细胞上可编码一种蛋白使病毒靶向该细胞的基因。他们希望这样做能够阻断对T细胞的感染。研究结果令人鼓舞,现在这种技术已在临床中用于若干其他疾病治疗。
CRISPR比其他基因编辑用起来更加简便,并且一次可以更好地编辑多种基因,June表示,当前的挑战是克服CRISPR“脱离靶标”编辑的倾向,这些都是身体系统切断或让计划之外的基因组产生突变的例证。尽管有防御措施,但免疫系统可能依旧会攻击经过编辑的细胞。
在RAC会议期间,委员会最大的一个担忧是潜在的利益冲突。除了其他经济牵连之外,June与瑞士制药公司诺华有着关系牵扯,拥有T细胞计数专利,可能会受益于此次临床试验的成功。June谢绝透露利益冲突的详细内容,但却表示他所在的宾尼法尼亚大学会采取措施应对该问题,比如他不会参与到患者挑选中。
若干RAC评审建议不让宾夕法尼亚大学挑选患者,而是让其他机构来挑选,但这一规定并未写入最终的批准要求中。然而,RAC委员会表示,他们对这项实验会非常小心。
“宾夕法尼亚大学历史上曾发生过一次很严重的冲突。”伊利诺伊州西北大学生物伦理学家 Laurie Zoloth说。有一个名字Jesse Gelsinger出现在讨论过程中,这名18岁的患者在1999年参与宾夕法尼亚大学一项早期基因治疗试验时死亡。随后的调查发现该研究存在很多问题,包括对该疗法不良作用的动物数据未作上报,以及研究人员在研究结果上的财政资助问题等。
但是加州斯坦福大学生物伦理学家、RAC委员Mildred Cho则认为,一项新疗法在动物实验中的安全性作用是有限的。“我们通常需要信仰的飞跃。”
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#基因剪刀#
69
要慎重,不要一窝蜂
183