Nat Biotechnol:治疗皮肤癌的黑色素瘤疫苗研究获新突破
2012-04-10 Beyond 生物谷
梅奥诊所研究人员将人黑色素瘤细胞的DNA与一种狂犬病病毒进行基因组合后,提高老鼠的免疫系统功能进而根除皮肤癌。这种战略称为癌症的免疫疗法,即采用基因工程改造过的水泡性口炎病毒直接将黑色素瘤细胞来源的广谱基因传递带肿瘤内。在早期的研究中,60%的荷瘤小鼠在不到3个月的时间内就得到治愈,并且副作用也很少。 最新研究结果发表在本周的《自然生物技术》杂志上。 梅奥诊所分子医学系研究人员、文章合著者
梅奥诊所研究人员将人黑色素瘤细胞的DNA与一种狂犬病病毒进行基因组合后,提高老鼠的免疫系统功能进而根除皮肤癌。这种战略称为癌症的免疫疗法,即采用基因工程改造过的水泡性口炎病毒直接将黑色素瘤细胞来源的广谱基因传递带肿瘤内。在早期的研究中,60%的荷瘤小鼠在不到3个月的时间内就得到治愈,并且副作用也很少。
最新研究结果发表在本周的《自然生物技术》杂志上。

梅奥诊所分子医学系研究人员、文章合著者Richard Vile博士与梅奥诊所的眼科医生和眼肿瘤学家Jose Pulido医师说:抗原刺激免疫系统抵抗癌症非常重要,我们相信这项新技术将帮助我们确定编码抗原的一整套新基因。尤其是我们已经看到,这些蛋白质需要同时表达才能最有效的抑制小鼠的肿瘤。
Vile博士有关黑色素瘤研究的成果进一步加快了梅奥诊所对研究实验癌症疫苗的投资,其中包括治疗肝癌的水泡性口炎疫苗的临床试验。未来的相关研究或许还会针对更具侵略性的癌症如肺癌、脑癌、胰腺癌等癌症疫苗展开。
Vile博士说:“我相信我们可以制造出将肿瘤细胞个个击破的癌症疫苗,通过接种靶向多种蛋白质的疫苗,我们希望我们将既能治疗原发肿瘤,同时也能防止癌症的复发。
免疫系统的功能是提供一个搜寻和摧毁平台,以确定病毒的入侵如水泡性口炎病毒。从肿瘤全谱DNA角度开发癌症疫苗的部分原因是因为肿瘤能适应健康的免疫系统反复的攻击,肿瘤细胞只表达较少的抗原,因此免疫系统不能识别肿瘤细胞。
癌症可以逃避正常的免疫系统,但似乎无法逃脱有水泡性口腔炎病毒存在的免疫系统的攻击。
Vile博士说:没有人知道免疫系统中有多少抗原能真正发现识别肿瘤细胞。通过表达高度免疫原性病毒所有蛋白质,我们能提高免疫系统对病毒的可见性。病毒表达那些原本应被清除的癌症相关抗原,入侵机体免疫系统。
许多肿瘤免疫治疗研究进度已经放缓,因为研究人员无法分离出肿瘤细胞中多样的抗原集合。在这些情况下,肿瘤会逃避人体免疫系统发生变异并重塑自己。
这项研究是与梅奥诊所与英国利兹大学分子医学研究所的Alan Melcher、Peter Selby教授合作开展,两人也为文章共同作者。
文章其他作者包括梅奥诊所的Timothy Kottke博士、Feorillo Galivo博士、Rosa Maria Diaz、Diana Rommelfanger-Konkol、Elizabeth Ilett和Larry Pease博士,英国吉尔福德萨里大学的Hardev Pandha病毒学博士,国家遗传工程和生物技术中心的Phonphimon Wongthida博士和英国伦敦肿瘤研究所的Kevin Harrington、Pathumthani、Thailand博士。
这项研究由理查德-舒尔茨家族基金会、梅奥诊所、英国癌症研究中心、国立卫生研究院资助。(生物谷:Bioon)

doi:10.1038/nbt.2157
PMC:
PMID:
Using virally expressed melanoma cDNA libraries to identify tumor-associated antigens that cure melanoma
Jose Pulido, Timothy Kottke, Jill Thompson, Feorillo Galivo, Phonphimon Wongthida, Rosa Maria Diaz, Diana Rommelfanger, Elizabeth Ilett, Larry Pease, Hardev Pandha, Kevin Harrington, Peter Selby, Alan Melcher, Richard Vile
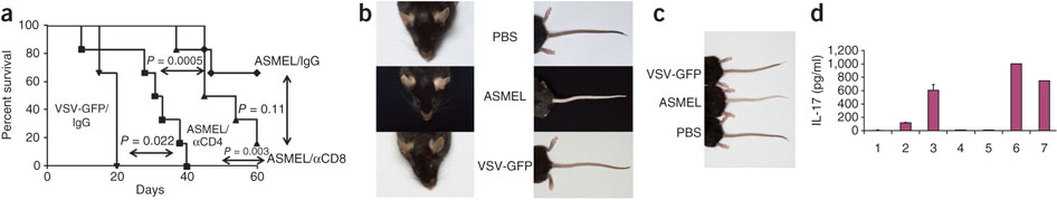
Multiple intravenous injections of a cDNA library, derived from human melanoma cell lines and expressed using the highly immunogenic vector vesicular stomatitis virus (VSV), cured mice with established melanoma tumors. Successful tumor eradication was associated with the ability of mouse lymphoid cells to mount a tumor-specific CD4+ interleukin (IL)-17 recall response in vitro. We used this characteristic IL-17 response to screen the VSV-cDNA library and identified three different VSV-cDNA virus clones that, when used in combination but not alone, achieved the same efficacy against tumors as the complete parental virus library. VSV-expressed cDNA libraries can therefore be used to identify tumor rejection antigens that can cooperate to induce anti-tumor responses. This technology should be applicable to antigen discovery for other cancers, as well as for other diseases in which immune reactivity against more than one target antigen contributes to disease pathology.
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#Bio#
47
#色素#
39
#TEC#
55
#Nat#
53
#新突破#
64
#Biotech#
43
#黑色素#
39
#黑色素#
0