晚期卵巢癌基于腹水/腹腔冲洗液进行基因检测可行吗?与肿瘤组织的一致性竟达95%
2024-01-06 苏州绘真医学 苏州绘真医学 发表于陕西省
从腹腔液提取cftDNA是可行的,可提供大量的肿瘤DNA。这种快速可靠的方法使HRD检测成为可能,包括BRCA1/2突变和基因组不稳定性评估。
了解晚期上皮性卵巢癌(EOC)的同源重组缺陷(HRD)状态对于患者管理至关重要。HRD 由BRCA1/2致病变异或基因组不稳定性决定。然而,在15-19%的病例中,肿瘤DNA分析并没有得出结论。>95%的晚期EOC病例可获得腹腔液,且腹腔液可作为HRD检测的游离肿瘤DNA(cftDNA)的替代来源。有限的数据显示基于腹水cfDNA的癌症基因panel检测的可行性,但迄今为止还没有研究调查HRD检测。研究者收集了53例EOC患者的腹水/腹腔冲洗液(19例来自回顾性队列,34例来自前瞻性队列),基于cfDNA,使用NGS对TP53/HR相关基因进行了癌症基因Panel(CGP)检测,并使用浅层全基因组测序(sWGS)对基因组不稳定性进行了检测。
结果显示,在53例患者中,49例(92.5%)可检测到cfDNA,包括腹腔液有限的患者。cfDNA中位数为3700 ng/ml,中位检测周转时间为21天。86%(42/49)的HGSOC患者检出TP53致病性变异。BRCA1和BRCA2致病性变异检出率分别为14%(7/49)和10%(5/49)。与基于肿瘤的TP53变异检测相比,腹腔cftDNA具有较高的灵敏度(97%)、特异性(83%)和一致性(95%)。在1例基于肿瘤检测失败的病例中,基于cftDNA的NGS CGP鉴定出了BRCA2致病性变异。即使基于肿瘤的基因组不稳定性检测失败,cftDNA的sWGS也提供了有意义的结果。
从腹腔液提取cftDNA是可行的,可提供大量的肿瘤DNA。这种快速可靠的方法使HRD检测成为可能,包括BRCA1/2突变和基因组不稳定性评估。研究者表示应向所有初次腹腔镜检查患者提供腹腔液cfDNA的HRD检测。
研究背景
卵巢癌是全球最致命的妇科癌症,每年有25万例病例和18万人死亡。高级别浆液性卵巢癌(HGSOC)是最常见和最具侵袭性的卵巢癌亚型,其5年总生存率为30%,主要是由于大多数EOC在诊断时已处于III或IV期(70%)。
约50%的HGSOC携带具有高度基因组不稳定性的同源重组缺陷(HRD),其原因可能是胚系或体细胞BRCA1/2致病性变异,也可能是另一种未知机制。PARP抑制剂(PARPi)可阻断单链断裂的修复,从而产生在HRD型肿瘤中无法修复的双链断裂。大型3期随机临床试验评估了PARPi作为晚期(FIGO III/IV期)高级别卵巢癌一线维持治疗的益处,目前已明确确定,通过BRCA1/2致病变异和基因组不稳定性检测确定的HRD状态可预测这类药物的获益程度。如今,为每例新诊断的高级别卵巢癌患者提供BRCA1/2基因致病变异和基因组不稳定性检测至关重要。不幸的是,由于肿瘤细胞密度低或DNA质量差,在福尔马林固定、石蜡包埋(FFPE)的肿瘤样本中,HRD检测在15%-19%的患者中产生了无效结果。对于不适合初次肿瘤减灭术的患者,这可能是一个特别值得注意的问题,因为唯一的肿瘤样本可能是诊断性腹腔镜检查时获得的小活检,或者新辅助化疗后间歇性肿瘤减灭术获得的坏死样本。超过一半的III/IV期高级别卵巢癌患者在诊断时表现出明显的恶性腹腔积液,另外还有一部分患者在手术探查时表现出少量细胞学证实的恶性腹腔游离积液。研究者最近证实,98%的III/IV期HGOC患者在诊断性腹腔镜检查或剖腹术中至少有少量临床可见的腹腔积液(腹水)。这种已知含有肿瘤细胞的腹腔液可为HRD肿瘤检测提供替代液体活检样本。
对游离肿瘤DNA(cftDNA)的研究已经进行了30年,它可以在各种体液中检测到,包括血液、尿液、胸腔积液和腹水。目前在一些癌症中常用,如EGFR突变的非小细胞肺癌。然而,关于腹水中的cfDNA(acfDNA)的研究较少。一些研究表明,acfDNA可以在胃或结肠癌中检测到。Han及其同事在10例卵巢癌患者的匹配肿瘤组织和腹水中发现了9个体细胞致病变异。另一项研究证实了18例卵巢癌患者的腹水中存在高浓度的cftDNA,并且有趣的是,与从肿瘤细胞中提取的DNA相比,cftDNA在腹水中产生了更高的变异丰度。这些结果提示,来自晚期卵巢癌患者腹水的cftDNA可提供替代的液体活检,以表征卵巢癌的基因组特征。
在本研究中,研究者旨在评估腹腔液cftDNA HRD检测在新诊断晚期卵巢癌患者中的可行性和临床实用性/性能。通过对来自Gustave Roussy癌症中心的53例晚期卵巢癌患者FFPE组织样本的匹配肿瘤DNA和腹水的cftDNA进行二代测序(NGS),分析了包括TP53(作为确认检测到肿瘤DNA的对照)、BRCA1/2和其他HR相关基因的癌症基因Panel(CGP)。此外,研究对FFPE肿瘤和腹腔液样本的cftDNA进行了基因组不稳定性检测。
研究方法
在第一阶段,研究者回顾性分析了2017-2021年期间,19例确诊为卵巢癌的患者在初次或二次腹腔镜检查中收集的腹水。然后,在2022年1月至2022年8月期间,研究者前瞻性地从初次或二次腹腔镜/剖腹术中疑似或确诊上皮性卵巢癌的患者中收集了腹腔液样本。随后被证实为非卵巢上皮癌原发灶(如胃肠道肿瘤或子宫内膜癌)的患者被排除出进一步的分析。此外,研究者还收集了7例需要在复发的情况下进行穿刺以控制症状的卵巢癌患者的腹水。最后,研究者对7例腹腔镜探查时无明显腹腔积液的患者,收集了腹腔冲洗液(简称间接腹水)。
每例患者的FFPE肿瘤组织标本的DNA均进行了基因组不稳定性检测(MyChoice Myriad®)。通过该方法可以确定基因组不稳定性评分(GIS), GIS是杂合性丢失(LOH)、端粒等位基因不平衡(TAI)和大片段迁移(LST)的算法测量。如果GIS≥42,则认为样本为HRD。MyChoice Myriad®检测无法对cfDNA进行,因此研究者使用sWGS评估了cftDNA样本的基因组不稳定性。这种方法是一种有吸引力的替代方法,因为它需要低的DNA起始量,是快速和经济有效的。使用sWGS进行的基因组不稳定性检测使用了shHRD算法。该算法基于大规模基因组变异(LGA)的数量,LGA定义为相邻节段≥10 Mb的染色体臂内CNA断裂。这是Myriad®HRD瘢痕试验中LST的反映。如果LGA≥20,则认为样本是HRD;如果LGA<15,则认为样本是HR正常。LGA介于15-19的样本被认为是“临界”。
研究结果
患者特征:
本研究共纳入53例患者(图1)。19例患者来自回顾性研究(18例为初次腹腔镜下腹腔积液,1例为间隔二次手术/腹腔镜下腹腔积液),34例患者来自前瞻性研究(17例为初次腹腔镜下腹腔积液,10例为二次腹腔镜下腹腔积液,7例为穿刺治疗)。在本病例系列中,间隔期手术探查时的腹水样本采集率高是由于一些患者在新辅助化疗3-4个周期后被转诊到本中心接受减瘤手术。
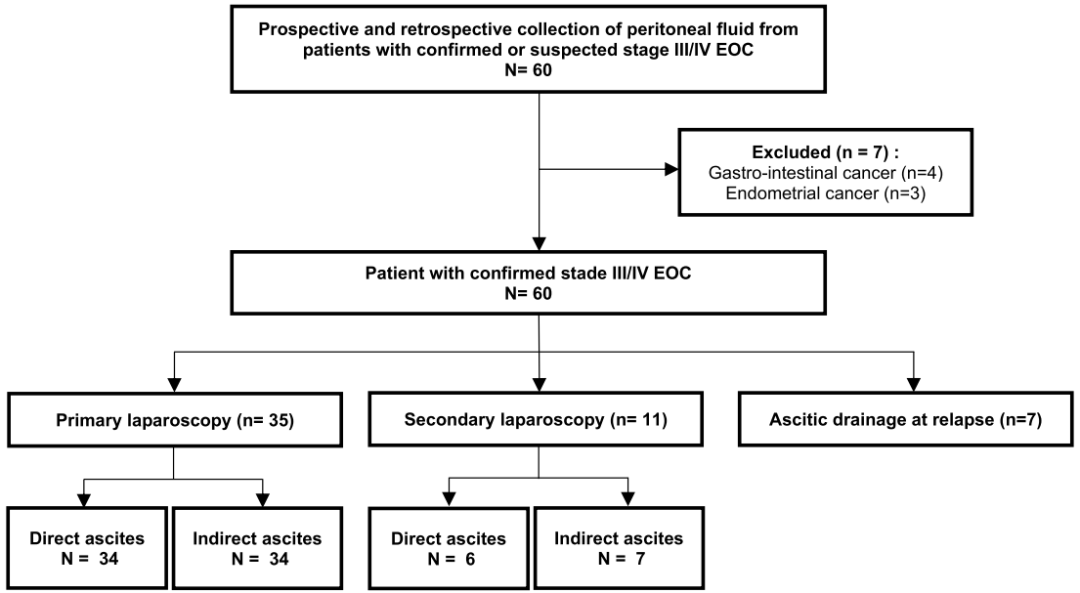
图1
在初次腹腔镜下直接获得腹腔积液的占34/35,二次腹腔镜下直接获得腹腔积液的占5/11,穿刺术中直接获得腹腔积液的占7/7。39例腹腔镜检查可见腹水的患者中,腹水容量20-100 ml者占18% (7/39),100-500 ml者占8% (3/39),500-1000 ml者占28% (11/39),1000 ml及以上者占46% (18/39)。对于无明显腹水的患者(初次腹腔镜,N=1;二次腹腔镜,N=6),通过生理盐水冲洗腹腔获得间接腹水。患者中位年龄65岁(范围:42-86岁),大多数患者为FIGO分期III/IV期(98%),高级别卵巢癌(92%,49/53),其他组织学类型包括低级别卵巢癌(N=4)。大多数腹水和肿瘤样本是在初次腹腔镜检查时采集的(66%)(表1)。

表1
腹腔液cftDNA检测:
在49/53例(92.5%)患者腹腔液中可检测到cfDNA。总体而言,DNA质量较高。图2显示了本研究中从腹腔液中提取的cfDNA的典型特征:一个平均长度为177 bp(范围:128-204)的单个单核小体峰,以及约360 bp和520 bp的另外两个峰。这表明从腹腔液中提取cfDNA的高质量,且高分子量DNA(>700-pb)污染低。
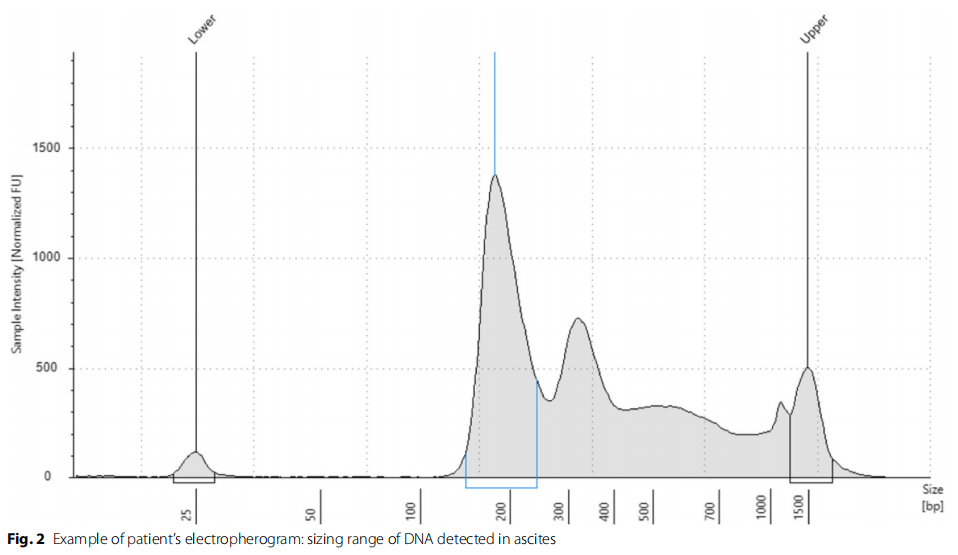
图2
此外,总cfDNA的中位浓度为3700 ng/ml(范围109-6 000 ng/ml),DNA产量非常高。报告的cfDNA浓度代表提取样本(1-4 ml腹水)中大小范围小于1000个碱基对的cfDNA浓度。腹腔灌洗患者的浓度也较高,中位浓度为1310 ng/ml(范围:1000-2120 ng/ml)。相比之下,从任何实体瘤患者的血浆中提取的cfDNA浓度通常范围为5-1500 ng/ml。仅考虑直接获得的腹水时,cfDNA在100%(46/46)的病例中检出,包括二次腹腔镜新辅助化疗后的腹水。重要的是,无论腹水的体积如何,直接获得的腹水均检测到cfDNA。腹水<100 ml组(N=7)和100-500 ml组(N=3)均检测到cfDNA,且腹水<500 ml患者的cfDNA中位浓度为3150 ng/ml(范围:20.9-15 900ng/ml)。值得注意的是,在无可见腹腔游离液且收集腹腔冲洗液的患者中,仍有42%(3/7)的患者检出cfDNA。未检出cfDNA的4例患者的特征见表2。所有标本均在新辅助化疗中位3.5个周期后经二次腹腔镜腹腔冲洗获得,所有患者均对化疗有良好的临床生物学反应。
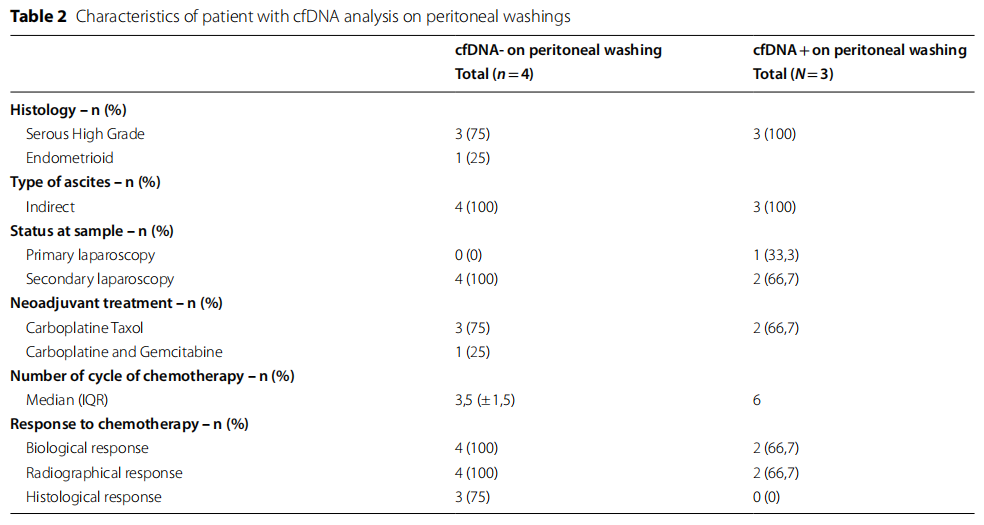
表2
腹腔液cftDNA的致病性变异检测:
至关重要的是,在49例检出cfDNA的患者中,96%的腹腔液样本检出致病性变异(47/49),因此证实当检出cfDNA时,几乎无一例外地含有肿瘤DNA(cftDNA)(图3)。在腹水cftDNA(acftDNA)未检出致病性变异的2例患者中,其中1例的NGS CGP也未在肿瘤组织中检出致病性变异。
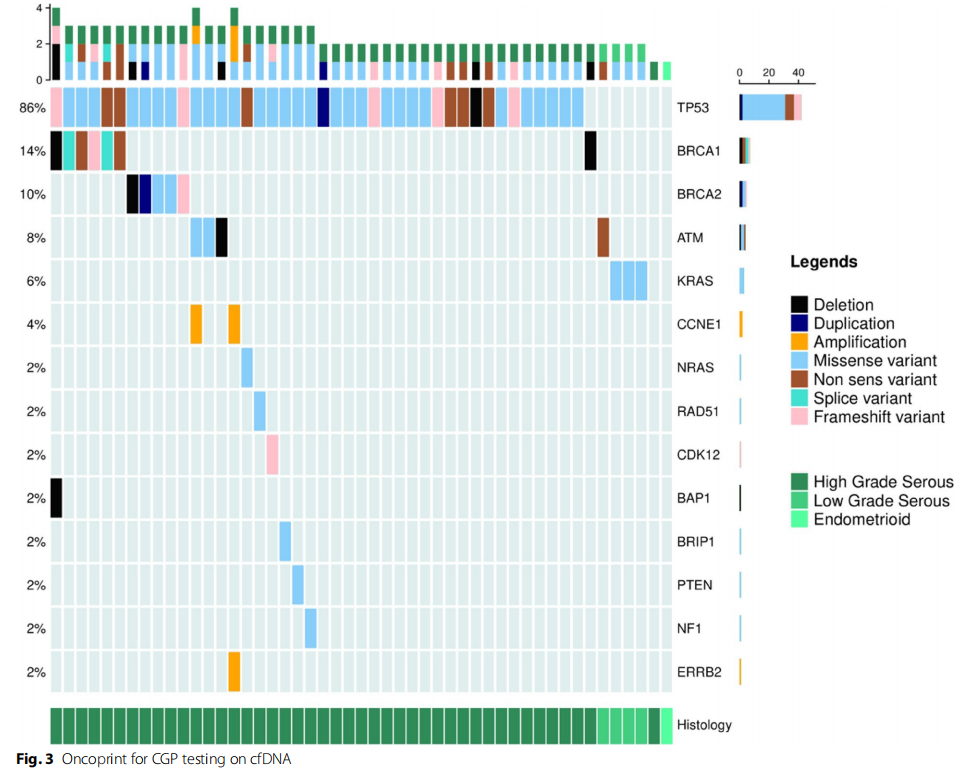
图3
在49份腹腔液样本中发现的最常见致病性变异是TP53(86%)(图3)。3份低级别卵巢癌acftDNA携带RAS致病变异,1份携带ATM致病变异。BRCA1和BRCA2致病变异检出率分别为14%(7/49)和10%(5/49),其中检出1例BRCA1大片段重排(外显子21-24缺失),证实了acftDNA检测此类定量事件的高质量。NGS检测acftDNA的中位周转时间仅为21天(14-36天)。
腹腔液cftDNA vs肿瘤样本的基因检测:
由于研究的主要目标是评估腹腔cftDNA的HRD检测性能,因此研究者聚焦于HGOC患者(N=49),并将cftDNA与基于肿瘤组织的检测进行了性能比较。NGS CGP对FFPE匹配组织样本中的DNA进行分析,在90%(44/49)的病例中发现了致病性变异。中位检测周转时间为45天(范围:14-96天),比acftDNA长。来自HGOC腹腔样本的cfDNA NGS与88%(43/49)检测的突变cftDNA相当。但如果仅分析直接获得的腹水中的cftDNA,ctDNA检出率更高,为98%(45/46)。对于腹水cfDNA(acfDNA)未检出致病性变异的患者,NGS CGP也未在肿瘤组织中检出致病性变异。对于肿瘤组织分析失败的5例患者,研究者在匹配的腹水样本中检测到TP53突变,包括acftDNA分析发现BRCA2致病性变异的1例患者。综上所述,这些数据支持医师可以通过腹水中的cftDNA检测来挽救无结果的肿瘤分析。
随后,研究者对灵敏度、特异性和一致性进行了评估,比较acfDNA和肿瘤检测对TP53致病变异的检出情况。本分析特别关注在cfDNA和肿瘤组织分析中均有检测结果的诊断为高级别卵巢癌的患者(N=42,占队列的80%)。表3中的一致性列对应于acfDNA和组织分析之间的一致性百分比。
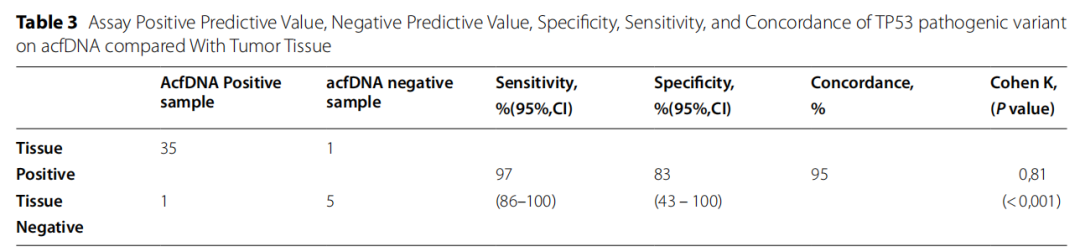
表3
灵敏度、特异性和一致性分别为97%(95%IC:86%-100%)、83%(95%IC:43%-100%)和95%(K=0.81:P<0.001)(表3)。1例不一致患者携带acftDNA检测到的TP53致病性变异,而组织DNA未检测到,这可能是由于细胞密度低,另1例患者在组织DNA中检测到TP53致病性变异,但acftDNA未检测到。
腹水中的平均变异丰度(VAF)也优于组织。TP53致病性变异的平均VAF在acftDNA中为54%,在ttDNA中为45%。对于BRCA1致病性变异,acftDNA的平均VAF为67%,ttDNA为63.3%;对于BRCA2致病性变异,acftDNA的平均VAF为80%,ttDNA为84.5%。
然而,令人惊讶的是,使用Pearson相关分析对组织和腹水中TP53的个体VAFs进行的检查显示,这两种样本类型之间没有显著的相关性(r=0.19,p=0.27)。
基因组不稳定性检测:
作为常规治疗的一部分,所有HGOC样本都进行了基于肿瘤的基因组不稳定性检测(Myriad MyChoice CDx),发表本文时,3份样本的结果尚未公布。44例患者的结果可获得,75%(33/44)的患者结果有效。在32例成功进行基于肿瘤的基因组不稳定性检测的患者中,16例(50%)被认为是HRD+(GIS>42)。
研究者对18份acftDNA样本(包括4份基于肿瘤的GIS失败的样本)进行了基于浅层全基因组测序的基因组不稳定性检测(sWGS HRD)。18例患者均有直接获得的腹水。18份样本的sWGS HRD均成功,包括4例肿瘤检测失败的样本,有效的基因组不稳定性检测结果为100%,10/18例acftDNA样本显示高基因组不稳定性(LGA>20),因此证实了对来自腹水的cftDNA进行基因组不稳定性检测的可行性。
讨 论
研究首次证明了对新诊断的晚期卵巢癌患者基于腹腔液cftDNA进行HRD检测的可行性和临床实用性,包括BRCA1/2致病变异分析以及基因组不稳定性检测。在全部病例中,92.5%病例的腹水样本检测到cfDNA,初次手术探查病例的为100%。值得注意的是,当检测到cfDNA时,96%的病例被证实为肿瘤。acftDNA的质量和数量都很好,中位周转检测时间为21天是非常可以接受的,比肿瘤分析的时间短。中位TP53 VAF(公认的卵巢癌中肿瘤细胞密度的替代指标)高于50%,突显出肿瘤DNA富集。重要的是,需要的腹水少于20 ml,即使在腹水少于100 ml的患者中,acftDNA分析也有帮助。为了评估该方法的广泛适用性,研究者之前的研究表明,在新诊断为III/IV期卵巢癌的患者中,98%在初次手术探查时有至少100 ml的游离腹腔积液,适合采用液体活检方法。
这些数据支持,来自少量直接或间接腹水的cfDNA可产生适于基因组分析的高质量肿瘤来源DNA。研究者的下一个重点是证明这种液体活检作为HRD检测工具的临床实用性。研究者在24%的acftDNA样本和具有匹配的肿瘤NGS结果的样本中发现了BRCA1/2致病性变异。在基因组不稳定性检测方面,组织样本中ttDNA的检测失败率高(25%)。相比之下,使用sWGS方法进行的基因组不稳定性检测在100%的acftDNA样本中是可行的,并且能够100%挽救基于肿瘤GIS检测失败的患者。综上所述,这些数据提示,来自腹腔液的acftDNA分析为组织HRD检测提供了一个合适的替代方案,可以替代肿瘤检测,并且可以在肿瘤检测无信息的情况下提供挽救策略。
所有的基因组检测,无论是acftDNA还是ttDNA,理想情况下都应该在初始诊断的未经治疗的样本中进行。然而,如果在初步诊断时未进行基因组检测或检测失败,本研究结果提示,也可以对新辅助化疗后间隔期减灭术时收集的腹水进行HRD检测。研究者甚至在没有游离液体的患者中证实了腹腔冲洗的有效性,因为在43%的病例中可检测到cftDNA。
与肿瘤检测相比,acfDNA检测TP53致病性变异的灵敏度、特异性和一致性分别为97%(95%IC:86%-100%)、83%(95%IC:43%-100%)和95%(K=0.81:P<0.001)。1例患者为TP53致病性变异,acfDNA检测到TP53致病性变异,但组织中漏检。重要的是,在5例肿瘤致病性变异分析无效的患者中,对来自腹水的cftDNA进行的NGS提供了信息,并发现了一个对胚系检测和治疗有明显直接意义的BRCA2致病性变异。
然而,该方法有局限性,主要与腹水的可及性有关。尽管大多数III/IV期卵巢癌患者在诊断时有腹腔积液(98%),但在某些情况下,需要进行HRD检测的患者可能没有表现出腹腔积液,甚至没有腹膜癌病,而只有腺病,因此对腹水cfDNA的分析无法用于HRD评估。当然,这在PARPi获批适应证患者中只占一小部分。
对于任何高级别卵巢癌,均必须确定HRD状态,并可通过BRCA1和BRCA2的CGP检测和基因组不稳定评分获得。然而,在本研究中,25%的患者没有提供HRD状态信息,由于基于肿瘤样本的NGS或Myriad®GIS无贡献。对于BRCA致病性变异分析和基因组不稳定性评分,acfDNA是一种有用且快速的替代肿瘤DNA分析方法。事实上,在本研究的所有acfDNA样本中,研究者能够使用sWGS检测基因组不稳定性,从而提供了原理证明。sWGS HRD基于大规模基因组变异(LGA)的数量,LGA定义为相邻节段≥10 Mb的染色体臂内CNA断裂。虽然这一特定算法尚未被批准用于卵巢癌的临床应用,但通过不同的学术(sWGS v2)和商业(sWGS v2)算法的sWGS HRD特征正在PARPi III期试验(PALOA-1)患者的临床样本中进行验证。本研究结果支持对腹腔液cftDNA进行基因组不稳定性检测是可行的。
利用腹腔液cftDNA进行肿瘤基因组分析是可行的,可获得高质量和高浓度的肿瘤DNA。重要的是,这种方法具有快速的检测周转时间,并且只需要20 ml腹水,因此>95%的晚期卵巢癌患者适合采用这种方法。结合BRCA1/2致病变异分析和基因组不稳定性评分,该acftDNA适用于评估HRD状态。在无腹水的罕见情况下,使用腹腔冲洗液也可能有价值。对于有BRCA或HRD状态的晚期卵巢癌患者,PARP抑制剂为无进展生存期和总生存期带来有意义的改善。不幸的是,仍有相当一部分最终复发。参与复发性疾病的临床试验几乎总是需要肿瘤组织的档案。保存存档的肿瘤组织以供以后的研究试验使用,或者指导生物标志物驱动的未来治疗决策仍然是优先事项。
参考文献:
Roussel-Simonin, Cyril et al. “Homologous recombination deficiency (HRD) testing on cell-free tumor DNA from peritoneal fluid.” Molecular cancer vol. 22,1 178. 6 Nov. 2023, doi:10.1186/s12943-023-01864-1

本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言












#卵巢癌# #基因检测# #腹腔冲洗液#
68