梁兴杰研究员/李景虹院士/胡中波教授AM:递送系统在改善过继细胞疗法中的研究进展与应用前景
2024-08-24 BioMed科技 BioMed科技 发表于上海
介绍过继细胞疗法在实体瘤治疗面临挑战,阐述多种传递策略结合的研究进展、机遇与挑战及展望。
过继细胞疗法(Adoptive Cell Therapy, ACT)在临床上治疗血液恶性肿瘤方面取得了巨大成功。然而,由于过继细胞的扩增不足和快速耗竭、肿瘤抗原的下调/丢失以及密集的肿瘤细胞外基质,单独使用ACT治疗实体瘤仍然面临挑战。组合细胞疗法的传递策略具有极大潜力,能够克服这些障碍。国家纳米科学中心梁兴杰研究员、清华大学李景虹院士、中国科学院大学胡中波教授等将疫苗、免疫检查点抑制剂、细胞因子、化疗药物和光热试剂与过继细胞结合使用,已被证明可以改善过继细胞的扩增/激活、减少耗竭,并促进过继细胞在实体瘤中的穿透。此外,直接在体内传递核酸以工程化免疫细胞,有望克服与复杂的体外细胞工程策略相关的许多障碍。在这里,讨论了这些研究进展,以及将传递技术整合到细胞疗法中的机会和挑战,并对这些新兴领域的展望进行了批判性分析。该研究以题为“Delivery Systems Developed for Treatment Combinations to Improve Adoptive Cell Therapy”的论文发表在《Advanced Materials》上。

图1描述了使用细胞疗法治疗实体瘤时遇到的多重障碍,包括制备过程的复杂性和耗时、体内扩增不足、免疫抑制性肿瘤微环境导致的过继细胞快速耗竭、密集的肿瘤细胞外基质对细胞渗透的阻碍,以及肿瘤细胞通过抗原丢失或异质性逃避免疫杀伤的机制。这些因素共同限制了ACT在实体瘤治疗中的有效性。这强调了为了提高ACT对实体瘤的治疗效果,必须克服这些障碍,这可能涉及到改进细胞制备技术、增强细胞扩增和激活、优化肿瘤微环境,以及解决肿瘤细胞的免疫逃逸问题。
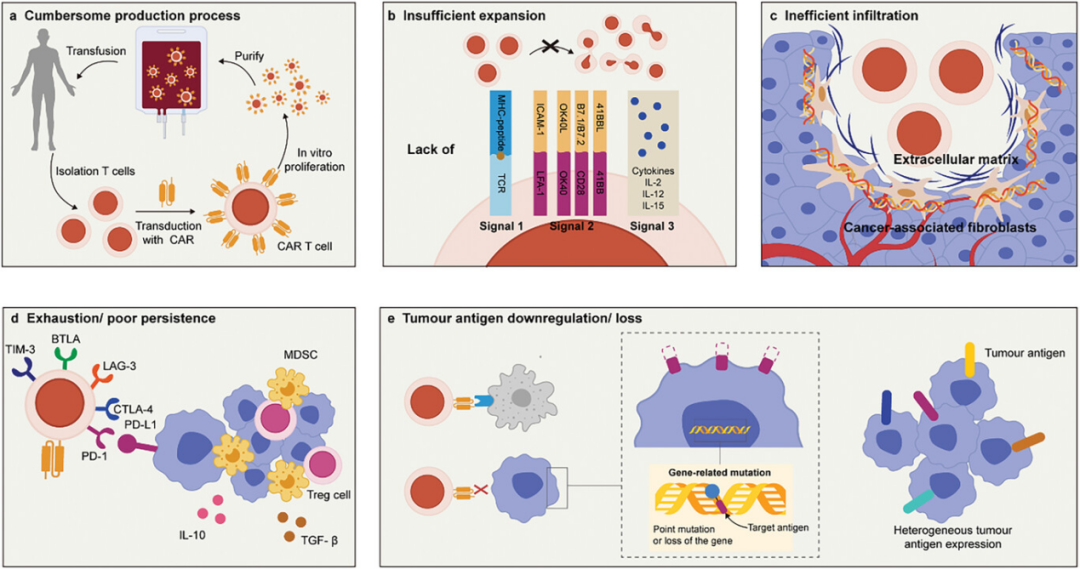
图1. 细胞治疗过程中的障碍
【疫苗传递与细胞疗法】
图2讨论了疫苗传递与细胞疗法的结合应用,展示了如何通过疫苗激活和扩增过继T细胞或产生针对肿瘤的适应性免疫反应来克服肿瘤对过继T细胞疗法的抵抗。具体内容包括利用溶瘤病毒作为原位疫苗来提升CAR T细胞疗法的效果,通过脂质纳米粒子传递mRNA编码的肿瘤抗原以激活特定的CAR T细胞,以及使用两亲性聚合物-脂质尾部连接的CAR配体疫苗靶向淋巴结并激活树突细胞,进而扩增CAR T细胞。因此,疫苗传递策略能够有效增强过继T细胞的体内激活和扩增,从而提高对肿瘤的免疫反应和治疗效果,这些策略为改善过继T细胞疗法提供了有力的工具和方法。
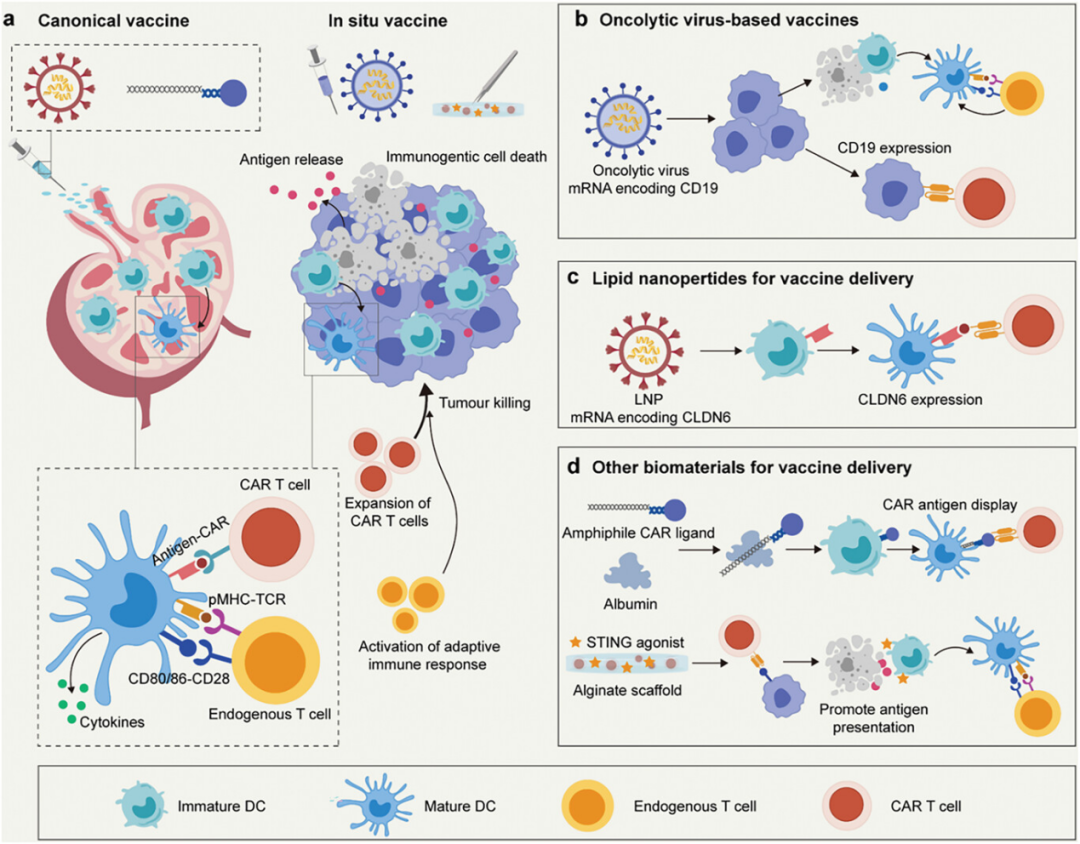
图2. 疫苗传递与细胞疗法
【疫苗增强过继细胞功能】
图3阐释了疫苗增强过继细胞功能的机制和效果。通过三次LNP-CLDN6疫苗增强,显著提升了CAR T细胞的扩增效果,并在表达CLDN6的大型Lewis肺癌小鼠模型中,展示了不同剂量组治疗后的肿瘤生长曲线和生存率。此外,通过共聚焦成像技术揭示了两亲性CAR T配体疫苗在淋巴结中CD11c+树突细胞上的积累,以及EGFRvIII衍生的短线性表位如何导致CAR T细胞在外围的大量扩增。这些强调了疫苗策略在促进CAR T细胞扩增和激活方面的有效性,这些策略包括利用纳米粒子传递肿瘤抗原编码的mRNA,以及设计能够靶向并激活树突细胞的疫苗,从而在体内激发对肿瘤的强烈免疫反应。
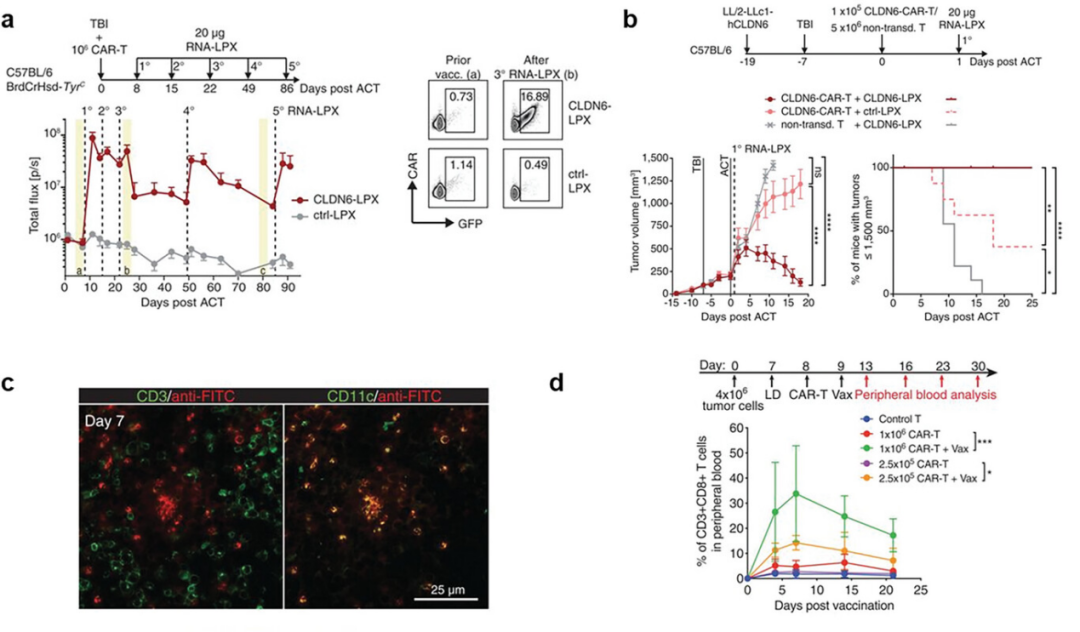
图3. 疫苗增强过继细胞功能
【用于组合细胞疗法的免疫检查点抑制剂和细胞因子的传递】
图4展示了用于组合细胞疗法的免疫检查点抑制剂和细胞因子的传递策略。这些策略包括使用支架材料进行植入式传递和注射型水凝胶进行肿瘤内注射,以实现对免疫检查点抑制剂或细胞因子的局部和控制释放。例如,通过将CAR T细胞和抗PD-L1抗体修饰的血小板封装在透明质酸水凝胶中,可以实现在手术后肿瘤切除腔中的缓慢释放,同时炎症因子可以触发血小板释放抗PD-L1抗体,减少CAR T细胞的耗竭并增强其对肿瘤细胞的杀伤效果。此外,通过将CAR T细胞、胶原模拟肽和多孔硅微球封装在多孔支架中,可以持续释放IL-15Sa,激活CAR T细胞并防止其耗竭。这些传递策略能够有效促进过继T细胞在肿瘤组织中的保留和激活,通过时空耦合效应协同增强抗肿瘤效果,同时避免了系统性给药可能引起的副作用。
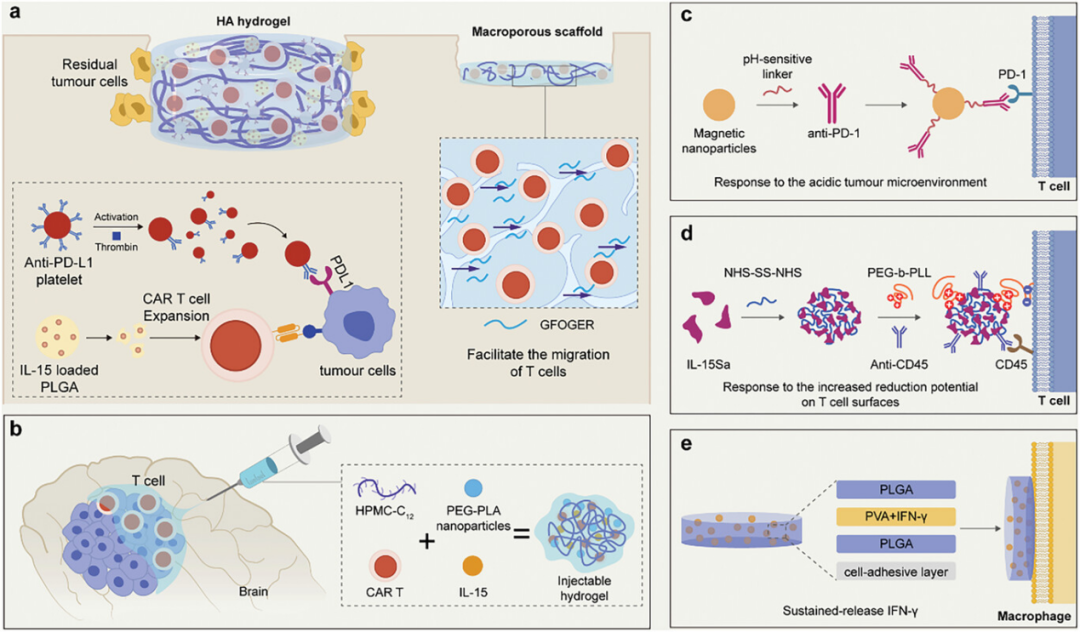
图4. 用于组合细胞疗法的免疫检查点抑制剂和细胞因子的传递
【用于组合疗法的CAR T细胞和免疫检查点抑制剂或细胞因子的传递】
图5详细描述了免疫检查点抑制剂和细胞因子传递系统在组合细胞疗法中的应用。这些系统包括使用透明质酸水凝胶封装CAR T细胞和血小板,以及利用聚合物纳米粒子(PNP)基纳米凝胶共传递CAR T细胞和IL-15。图中展示了通过冷冻扫描电子显微镜成像的透明质酸水凝胶中封装的CAR T细胞和血小板,以及不同治疗方式后WM115黑色素瘤的生物发光强度和体积变化。此外,还展示了肿瘤浸润的Thy 1.1+CD8+ T细胞频率和转移的T细胞及内源性T细胞在肿瘤中的计数。这些强调了这些传递策略在促进CAR T细胞在肿瘤组织中的长期保留、激活和扩增方面的有效性,这些策略通过局部和持续的细胞因子释放,以及通过物理结构或纳米凝胶的创新设计,显著提高了CAR T细胞疗法的抗肿瘤效果,并减少了系统性给药可能引起的副作用。
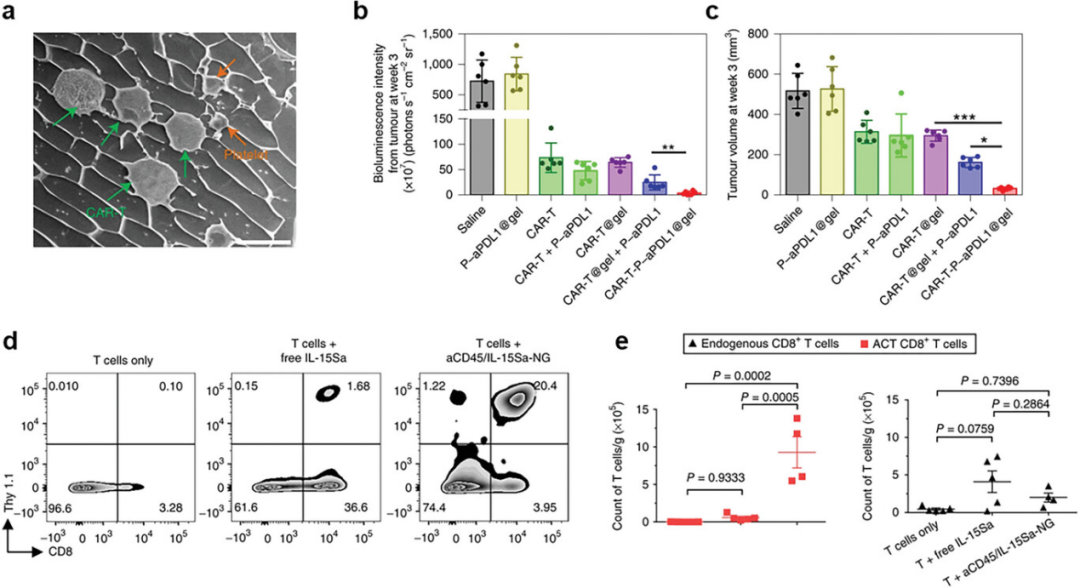
图5. 用于组合疗法的CAR T细胞和免疫检查点抑制剂或细胞因子的传递
【化疗药物传递和细胞疗法】
图6展示了化疗药物传递与细胞疗法的结合策略,包括通过细胞搭便车和背包策略将化疗药物精确地传递到肿瘤组织。具体内容包括:a) 中性粒细胞搭便车传递紫杉醇载药脂质体,直接对肿瘤细胞产生化学毒性;b) T细胞背包传递avasimibe载药脂质体,通过调节胆固醇代谢来增强TCR聚集;c) T细胞背包传递SCH-58261载药脂质体,阻断腺苷受体,抑制腺苷介导的免疫抑制途径。通过这些创新的传递策略,可以有效提高化疗药物在肿瘤部位的浓度,同时减少对正常细胞的毒性,从而增强了化疗与细胞疗法的协同效果,为提高治疗效果提供了新的可能性。
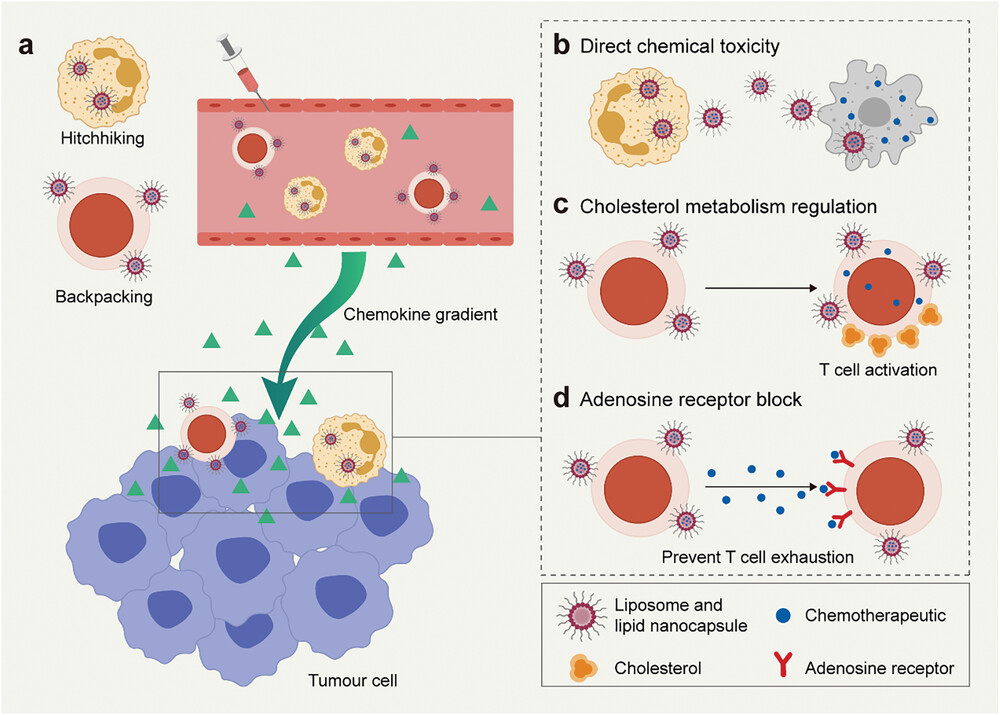
图6. 化疗药物传递和细胞疗法
【光热疗法和细胞疗法】
图7展示了光热疗法(PTT)与细胞疗法相结合在提高过继T细胞疗效方面的潜力。通过光热效应,可以破坏实体瘤中的细胞外基质,降低肿瘤组织中的压力,增加血液灌注,从而促进CAR T细胞在肿瘤组织中的渗透和积累。此外,光热还能激活CRISPR-Cas9系统,通过敲除肿瘤细胞中的抗凋亡蛋白,提高CAR T细胞的杀伤效果。同时,利用光响应型纳米颗粒,可以实现对CAR T细胞活性的远程控制,通过近红外光触发CAR T细胞分泌细胞因子,增强其在肿瘤组织中的激活和扩增。因此,光热疗法与细胞疗法的结合为实体瘤治疗提供了一种新的思路,通过光热效应改善肿瘤微环境,提高过继T细胞的疗效,展现了在癌症治疗中应用光热调控策略的巨大潜力。
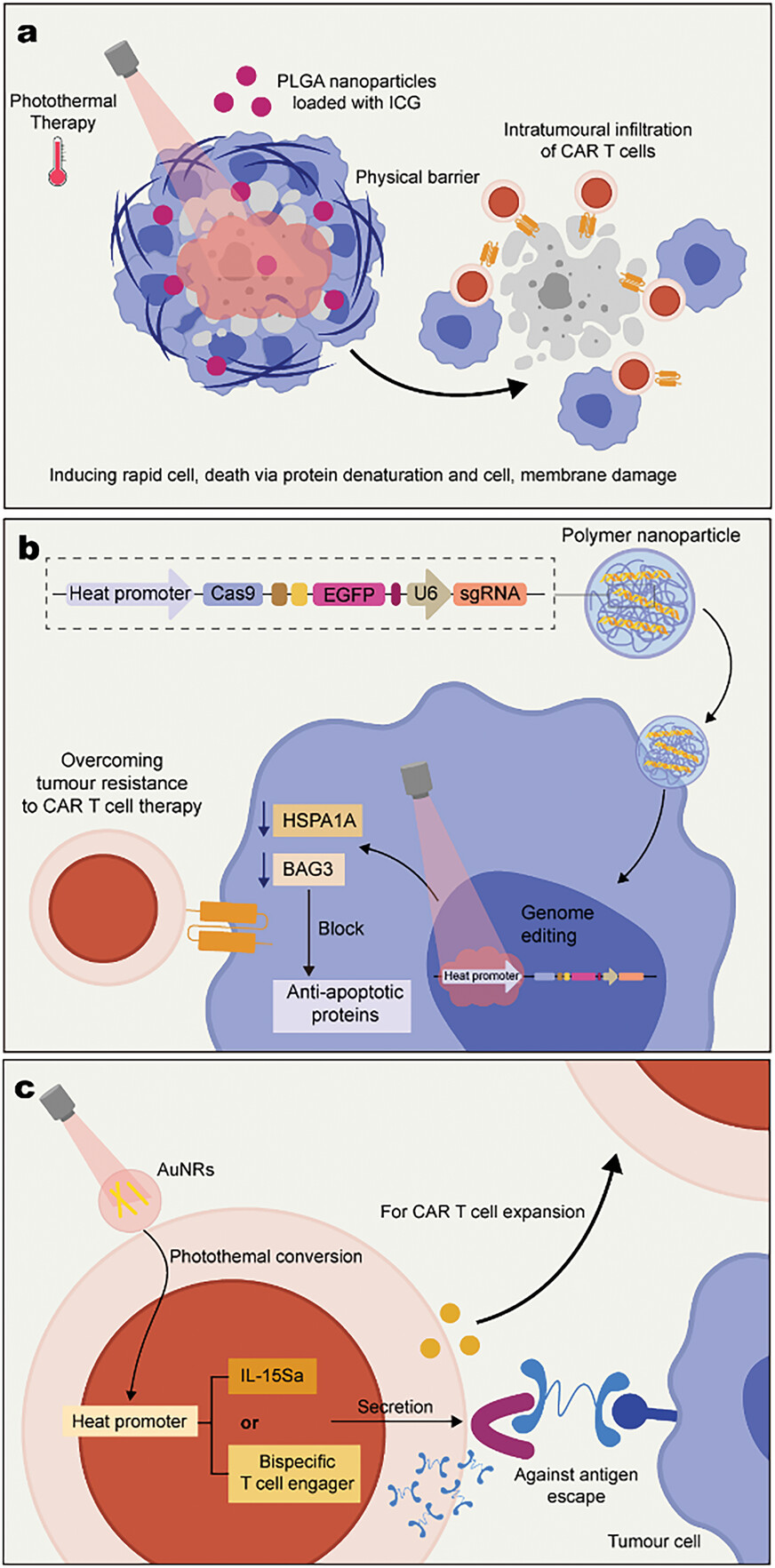
图7. 光热疗法和细胞疗法
【用于体内免疫细胞工程的核酸传递】
图8讨论了体内工程化免疫细胞的策略,这些策略通过病毒和非病毒核酸传递系统实现。具体来说,展示了一种可植入的多功能海藻酸盐支架,用于T细胞工程和释放,以快速在体内制造并释放CAR T细胞。此外,还介绍了非病毒核酸传递方法,包括使用聚(β-氨基酯)(PBAE)基纳米粒子共传递携带CAR的piggyBac转座子质粒和转座酶质粒,以及使用聚合物纳米粒子传递mRNA,这些方法能够在体内有效地产生并扩增CAR T细胞或CAR巨噬细胞。这些强调了体内细胞工程策略的简便性、可控性,以及它们在提高免疫细胞疗法的效率和安全性方面的潜力,为传统体外细胞工程提供了一种有前景的替代方案。
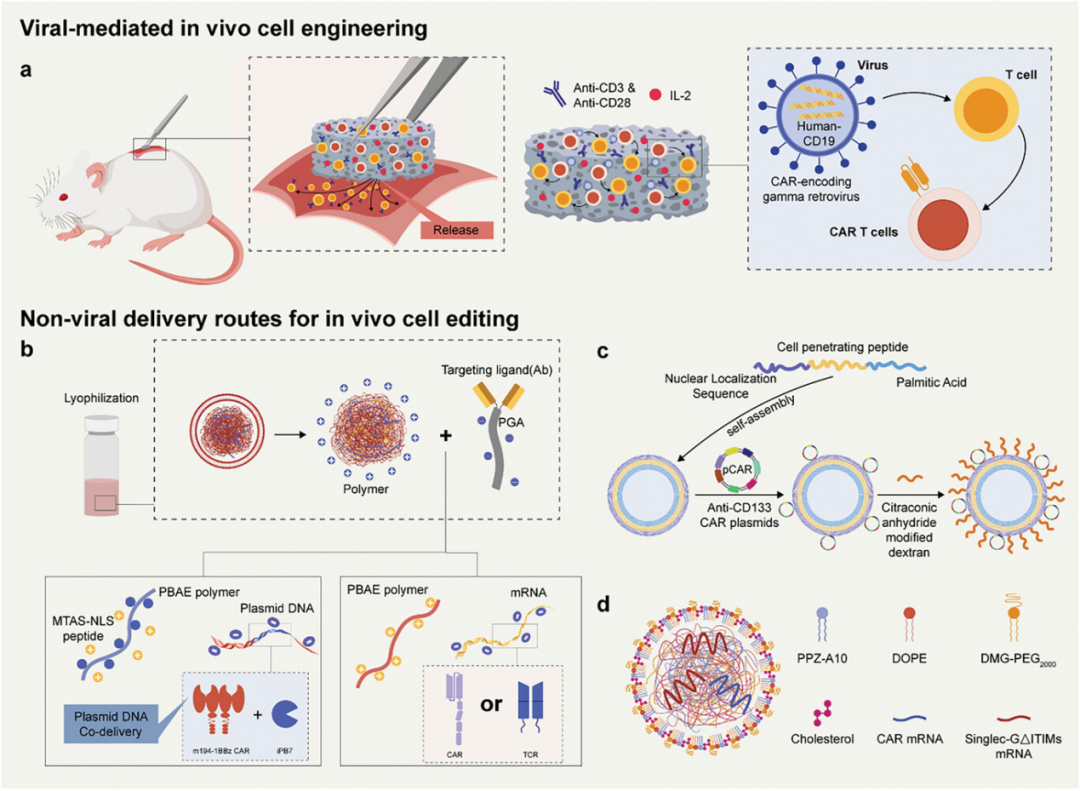
图8. 用于体内免疫细胞工程的核酸传递
【体内T细胞工程的传递策略】
图9展示了通过不同的策略实现体内T细胞工程的研究成果。具体来说,通过使用植入式支架技术,可以在体内有效地转导并释放CAR T细胞,这些细胞在小鼠淋巴瘤异种移植模型中显示出更好的持续性和杀伤肿瘤的能力。此外,利用聚(β-氨基酯)(PBAE)基纳米粒子共递送携带194-1BBz CAR和转座酶的质粒,成功在体内制造了CAR T细胞,这些细胞在小鼠B细胞急性淋巴细胞性白血病模型中诱导了白血病的回归,效果与传统的体外转导CAR T细胞相当。这些研究结果表明,体内T细胞工程策略不仅能够简化制备流程,降低成本,还具有与传统体外方法相当的疗效,为未来的癌症治疗提供了新的可能性。
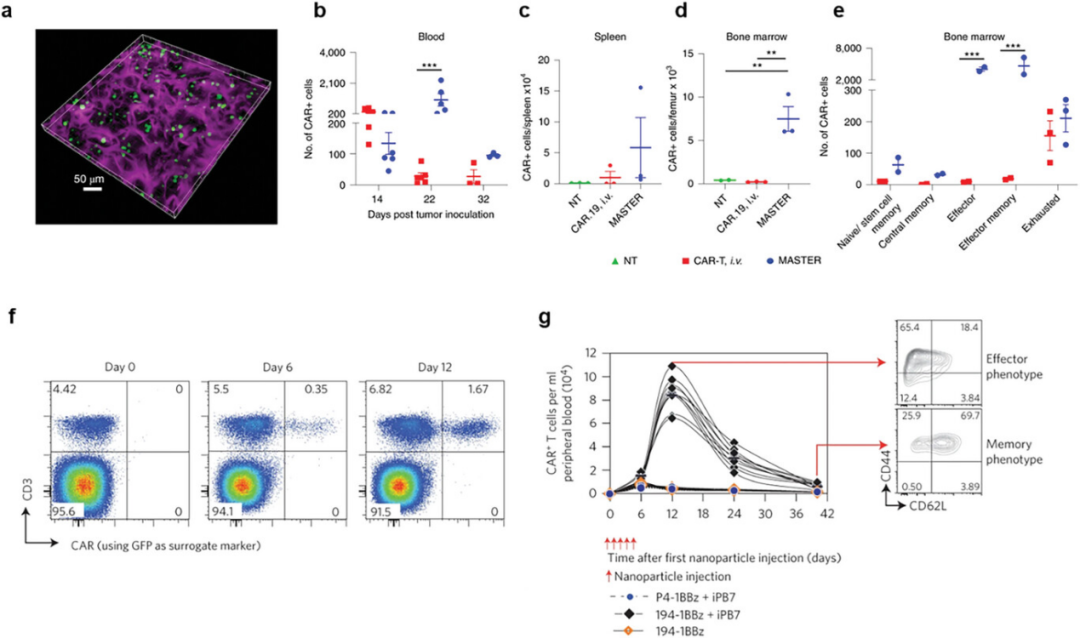
图9. 体内T细胞工程的传递策略
【小结】
过继细胞疗法(ACT)通过多种传递技术的整合应用,展现出改善实体瘤治疗的巨大潜力。尽管ACT在血液恶性肿瘤治疗中取得了显著成效,但在实体瘤治疗中仍面临诸多挑战,包括过继细胞扩增不足、快速耗竭、肿瘤抗原下调或丢失,以及肿瘤细胞外基质的致密性等问题。文章讨论了如何利用传递策略,例如结合疫苗、免疫检查点抑制剂、细胞因子、化疗药物、光热试剂以及核酸酸直接工程化免疫细胞等,来克服这些障碍。这些策略不仅增强了过继细胞的体内激活和扩增,减少了耗竭,还提高了细胞在肿瘤中的渗透能力。此外,文章还批判性地分析了这些新兴领域的机遇与挑战,并展望了未来发展方向,指出了在临床转化过程中需要考虑的安全性、有效性以及精确控制释放机制等问题。总之,传递技术的发展为提高ACT的疗效和安全性提供了新的思路和方法,预示着下一代癌症治疗技术的发展前景。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202407525
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言








#实体瘤治疗# #过继细胞疗法#
23