Nature子刊:郝海平/叶慧/王南溪合作揭示人类蛋白质组存在丰富乳酰化修饰谱
2022-07-05 生物世界 生物世界
该研究表明,乳酰化是广泛存在于人类组织和细胞中的一种非组蛋白特异性的、具有生物学功能的翻译后修饰。
2022年6月27日,中国药科大学郝海平/叶慧团队和南京中医药大学王南溪团队合作,在 Nature Methods 期刊在线发表了题为:Cyclic immonium ion of lactyllysine reveals widespread lactylation in the human proteome 的研究论文。
该研究表明,乳酰化是广泛存在于人类组织和细胞中的一种非组蛋白特异性的、具有生物学功能的翻译后修饰。

该工作针对乳酸是否可以直接共价修饰非组蛋白进而发挥生物学效应的科学问题,提出在公共的人类蛋白质组深度测序数据中搜索乳酰化修饰的新底物蛋白的策略。然而,由于从非富集的蛋白质组数据中检索修饰的假阳性率极高,若能发现修饰特异性的特征离子则能通过谱图筛选,显著降低鉴定的假阳性率,揭示真实修饰位点和靶蛋白,指导后续的生物学验证。
基于此需求,研究团队通过合成和研究模型乳酰化肽段的谱图,首次发现了携带乳酰化修饰赖氨酸的多肽在碰撞室中经过二级断裂会形成链状亚胺离子,该离子经过脱氨形成次生碎片——环状亚胺离子。进一步通过分析生物样本中富集的大量乳酰化阳性肽段,再以近十万条人类蛋白质组的非修饰肽段谱图作为阴性对照,确证了环状亚胺离子指征乳酰化修饰的灵敏度和特异性,提出该离子作为判定数据库检索的乳酰化真实与否的金标准。
基于该诊断离子策略,研究者从现有的非富集、大规模人类蛋白质组数据资源中挖掘了全新的、丰富的乳酰化修饰底物蛋白和位点的信息,特别是从2020年 Nature Methods 发表的 Meltome Atlas 库的人类细胞蛋白质组热稳定性数据中,发现乳酰化修饰高度富集在糖酵解通路。其中,代谢酶 ALDOA 的乳酰化修饰存在于多种人类肿瘤细胞系且修饰占位比高,引发了乳酰化修饰调节代谢酶活性等功能,进而调控糖酵解通路的猜想。
郝海平、叶慧团队进一步联合王南溪课题组,利用先进的化学生物学技术——基因密码子扩展技术,首次实现向靶蛋白 ALDOA 定点引入乳酰化修饰,并发现修饰后酶活性显著降低,揭示了乳酸蓄积后,能通过共价修饰糖酵解通路的上游代谢酶,抑制糖酵解活跃度的反馈调节机制,对生物化学领域现有的“终产物抑制”的调控模式进行了补充。
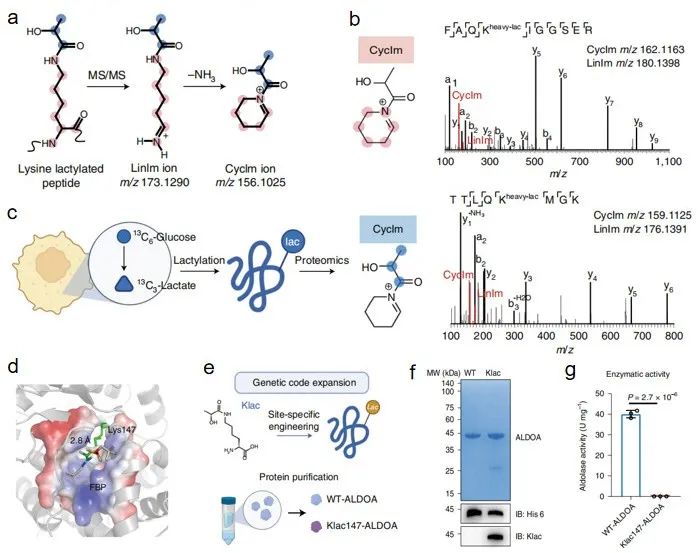
乳酰化赖氨酸的环状亚胺离子揭示人类蛋白质组中保守的修饰底物
综上,该研究表明乳酰化是广泛存在于人类组织和细胞中的一种非组蛋白特异性的、具有生物学功能的翻译后修饰。该示踪技术的应用能够助力在未来发现更多样的乳酰化修饰蛋白,并且揭示乳酰化修饰的动态变化与乳酸紊乱驱动炎症、肿瘤等重大慢性疾病发生发展的关联,提示新的治疗靶点。
中国药科大学2019级博士研究生皖宁和2018级硕士研究生王念为论文共同第一作者,中国药科大学叶慧特聘研究员、郝海平教授和南京中医药大学王南溪教授为共同通讯作者,中国药科大学为本文的第一通讯单位。该工作的主要合作者包括王广基院士、邵畅博士和余思琴、张汉卿、王德祥、陆文捷、孔影、王鑫淼、吕浪浪等。
论文链接:
https://www.nature.com/articles/s41592-022-01523-1
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#蛋白质组#
82
#白质#
71
#Nat#
103
#蛋白质#
80
#修饰#
109