Cancer Cell:CDKN2A基因缺失重塑脂质代谢,诱发胶质母细胞瘤铁死亡
2023-05-29 生物世界 生物世界 发表于上海
该研究显示,一种存在于大约60%的胶质母细胞瘤患者中的基因突变——CDKN2A基因缺失,会导致癌细胞中脂质代谢和分布方式的改变从而引发胶质母细胞瘤细胞的铁死亡。
胶质母细胞瘤(GBM)是最常见和致命的脑肿瘤。由于这类肿瘤恶性程度极高、发展迅速,所以绝大部分患者预后极差:胶质母细胞瘤患者经过手术放化疗等治疗手段后,其生存中位数仅为15个月左右,五年生存率不到5%。
癌症中的分子改变会导致特定的代谢脆弱性,因此,针对癌症的代谢脆弱性,可能开发出新的癌症治疗方法。在癌细胞系中进行的大规模多组学研究表明,在特定的癌症分子亚群中可能存在不同的代谢脆弱性。然而,由于在体外培养细胞系中的分子和代谢与癌症患者体内的真实情况存在差距,这限制了科研发现向癌症疗法的有效转化。因此,考虑人类肿瘤的分子多样性及其环境对于确定癌症患者可转化的代谢靶点至关重要。
2023年5月25日,加州大学洛杉矶分校(UCLA)的研究人员在 Cancer Cell 期刊发表了题为:CDKN2A deletion remodels lipid metabolism to prime glioblastoma for ferroptosis 的研究论文。
该研究显示,一种存在于大约60%的胶质母细胞瘤患者中的基因突变——CDKN2A基因缺失,会导致癌细胞中脂质代谢和分布方式的改变,从而引发胶质母细胞瘤细胞的铁死亡(ferroptosis),这项研究发现了胶质母细胞瘤的代谢脆弱性,为开发针对这一弱点的治疗方法奠定了基础。

论文通讯作者 David Nathanson 表示,这项研究发现CDKN2A可能是癌细胞代谢的关键调节因子,重要的是,CDKN2A缺失不仅在胶质母细胞瘤模型中改变了脂质代谢,在胶质母细胞瘤人类患者中也同样改变了脂质代谢,这表明这种代谢脆弱性可能是胶质母细胞瘤患者的治疗新靶点。
胶质母细胞瘤(GBM)是一种非常致命的脑肿瘤,具有广泛的遗传和转录异质性。胶质母细胞瘤中特定的致癌基因突变会重编程胶质母细胞瘤细胞的脂质代谢,例如EGFR基因突变、IDH基因突变,这提示了我们可以利用其改变的肿瘤代谢进行治疗。
在胶质母细胞瘤中发现的不同分子景观是否导致异质性脂质组表型和不同的代谢脆弱性尚不清楚。在这项最新研究中,研究团队建立了一个大型分子注释的胶质母细胞瘤及其衍生物的体外和体内原位模型库,以寻找特定分子病变与脂质代谢表型之间的临床相关关系。
研究团队分析了84个胶质母细胞瘤肿瘤、42个胶质母细胞瘤人类细胞系和30个胶质母细胞瘤小鼠模型的数据,包括脂质组学、转录组学和基因组数据,以寻找癌细胞处理脂质的可能模式。结果显示,这些胶质母细胞瘤中的CDKN2A基因存在异常,该基因在大多数胶质母细胞瘤患者(约60%)中发生突变。
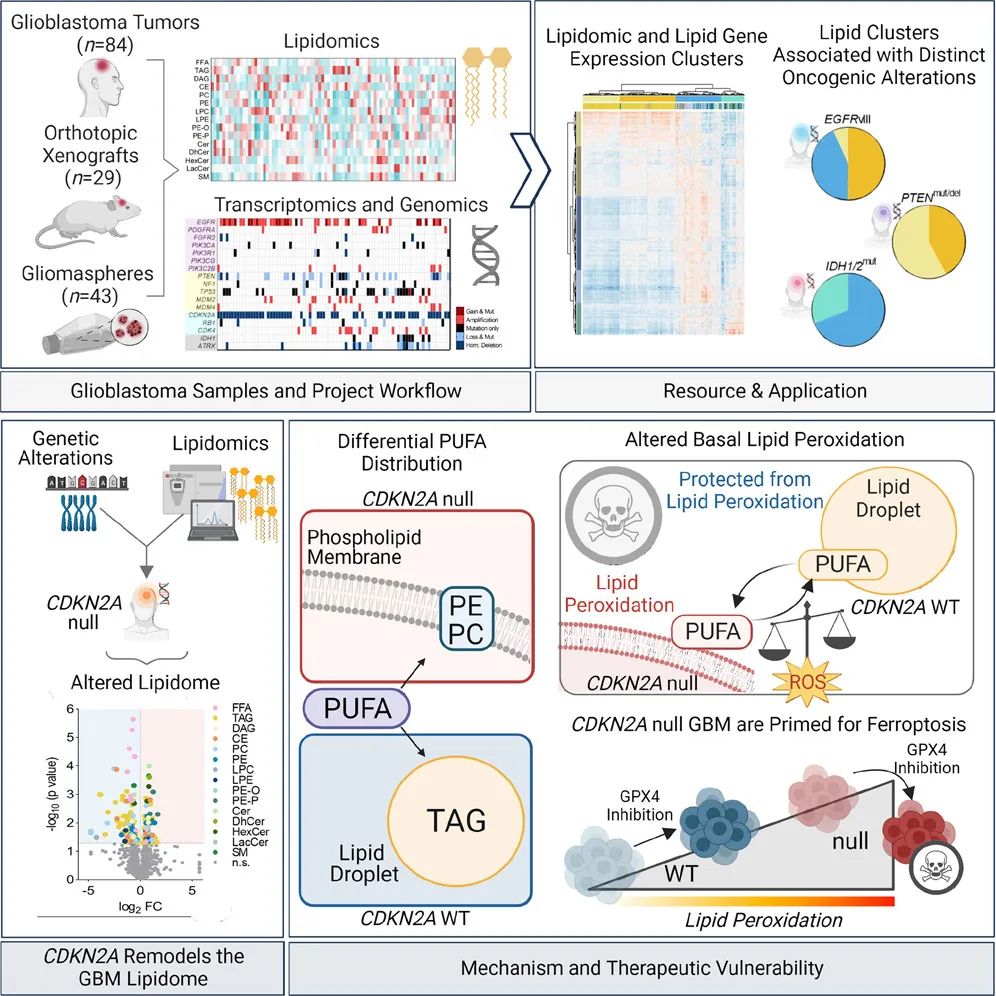
CDKN2A基因的缺失重塑了胶质母细胞瘤脂质组,特别是将可氧化的多不饱和脂肪酸重新分配到不同的细胞脂质区室。CDKN2A基因缺失的胶质母细胞瘤表现出更高的脂质过氧化,选择性地引发了肿瘤细胞的铁死亡(ferroptosis)。使用RSL3(一种GPX4抑制剂,激活铁死亡)处理,CDKN2A基因缺失的胶质母细胞瘤细胞对铁死亡非常敏感,而没有CDKN2A基因缺失的胶质母细胞瘤细胞则对该药物不敏感。
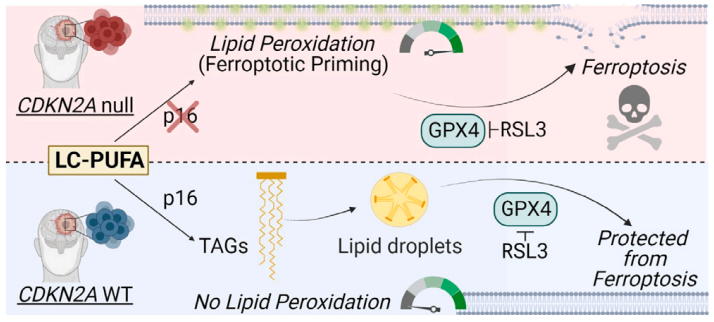
总的来说,该研究发现胶质母细胞瘤患者中大量存在CDKN2A基因缺失,这一基因突变会重塑癌细胞的脂质代谢,诱发胶质母细胞瘤的铁死亡(ferroptosis)。使用RSL3(一种GPX4抑制剂,激活铁死亡)治疗,能够诱导CDKN2A基因缺失的胶质母细胞瘤细胞的铁死亡,而铁死亡现在正在成为几种癌症的新的治疗靶点。目前还没有能够靶向大脑的GPX4抑制剂来激活铁死亡,但这项研究为我们进一步开发能够通过血脑屏障的铁死亡激活剂来治疗胶质母细胞瘤提供了理论依据。
论文链接:
https://doi.org/10.1016/j.ccell.2023.05.001
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言