本文目录



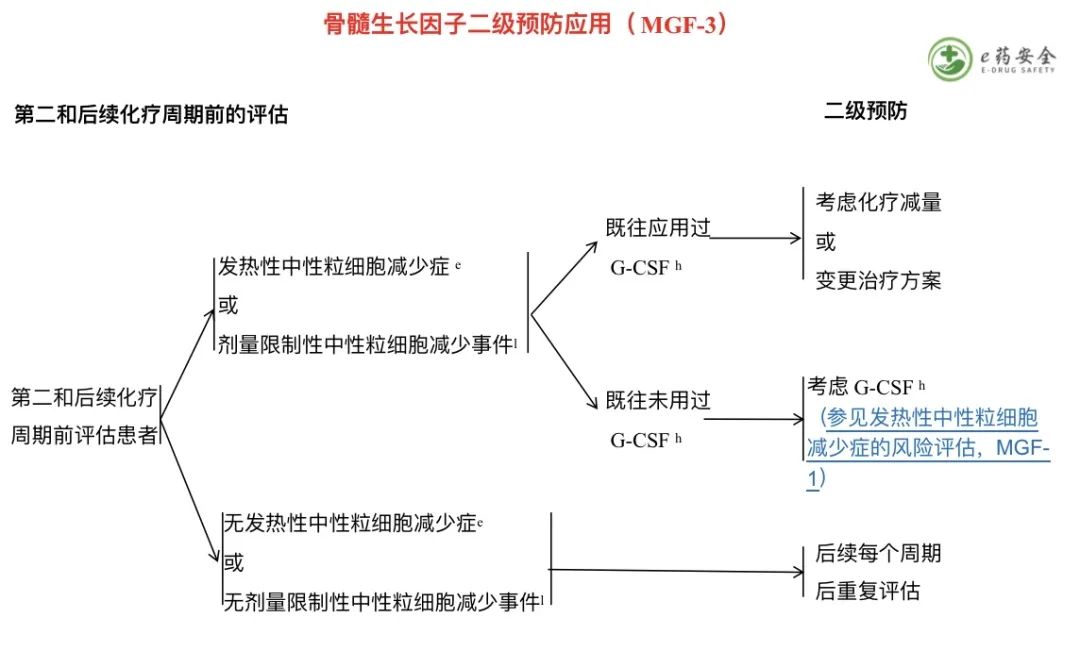
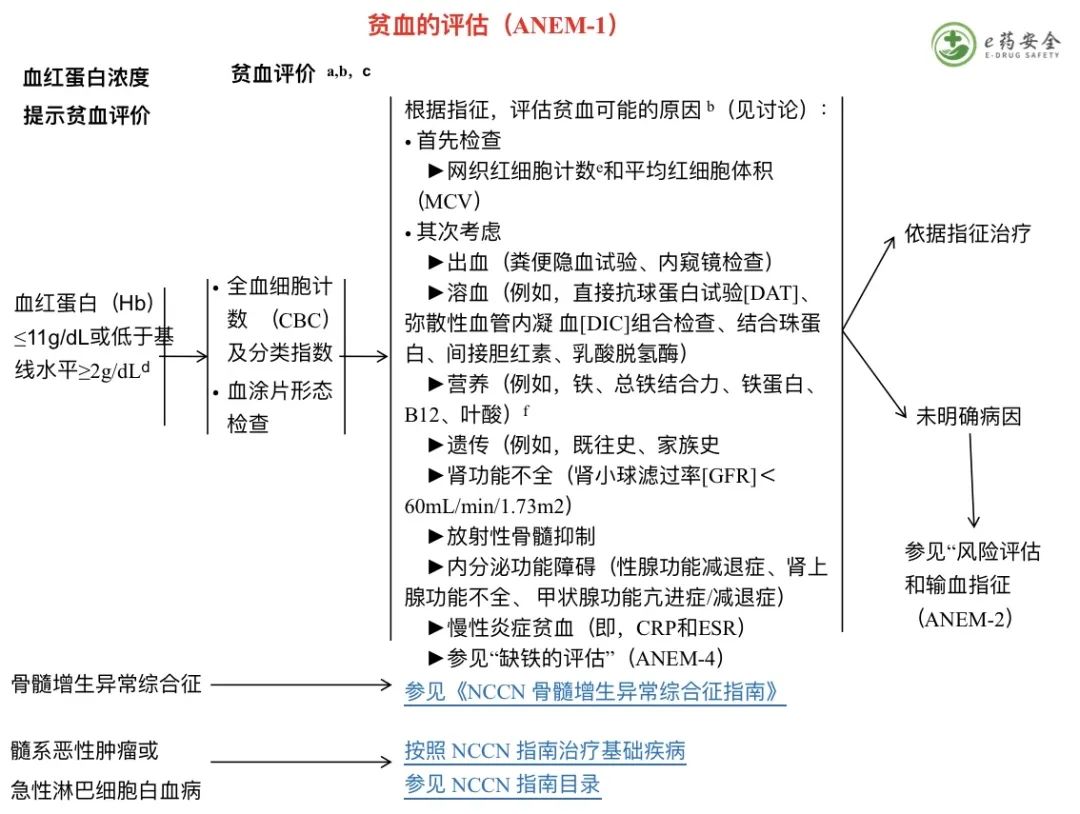
e. 发热性中性粒细胞减少症的定义是:单次口腔温度≥38.3℃或≥38.0℃持续 1 小时;以及伴中性粒细胞减少症:中性粒细胞<500/mcl 或者中性粒细胞<1000/mcl,但预计在随后的 48 小时内将下降至≤500/mcl。参见《NCCN 肿瘤相关感染的预防和治疗指南》。
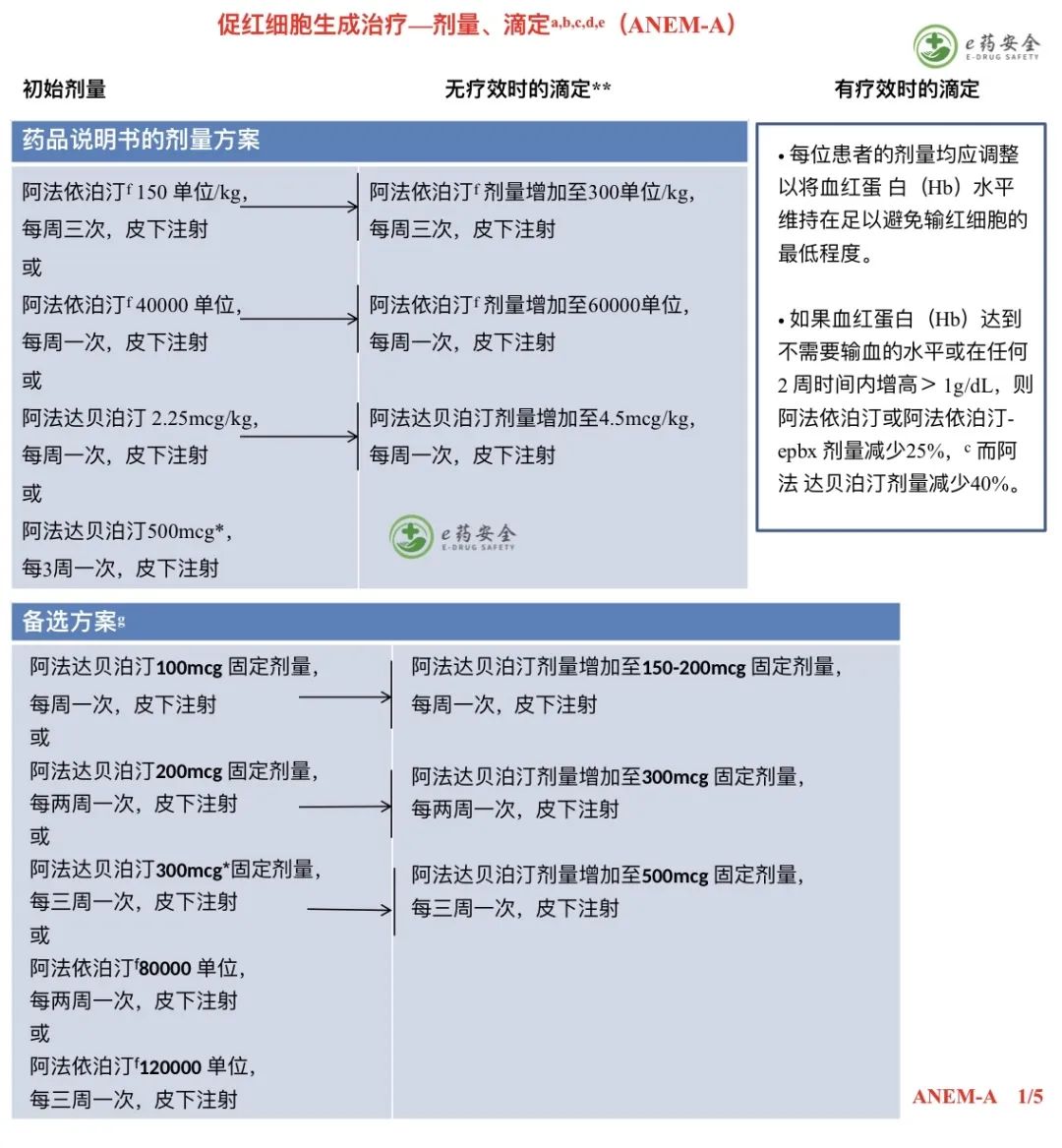
h. 参见“G-CSF 在预防发热性中性粒细胞减少症及维持计划剂量给药中的应用”(MGF-B)。
l.剂量限制性中性粒细胞减少事件指的是可能影响到化疗计划剂量的(中性粒细胞)最低计数或治疗日计数。
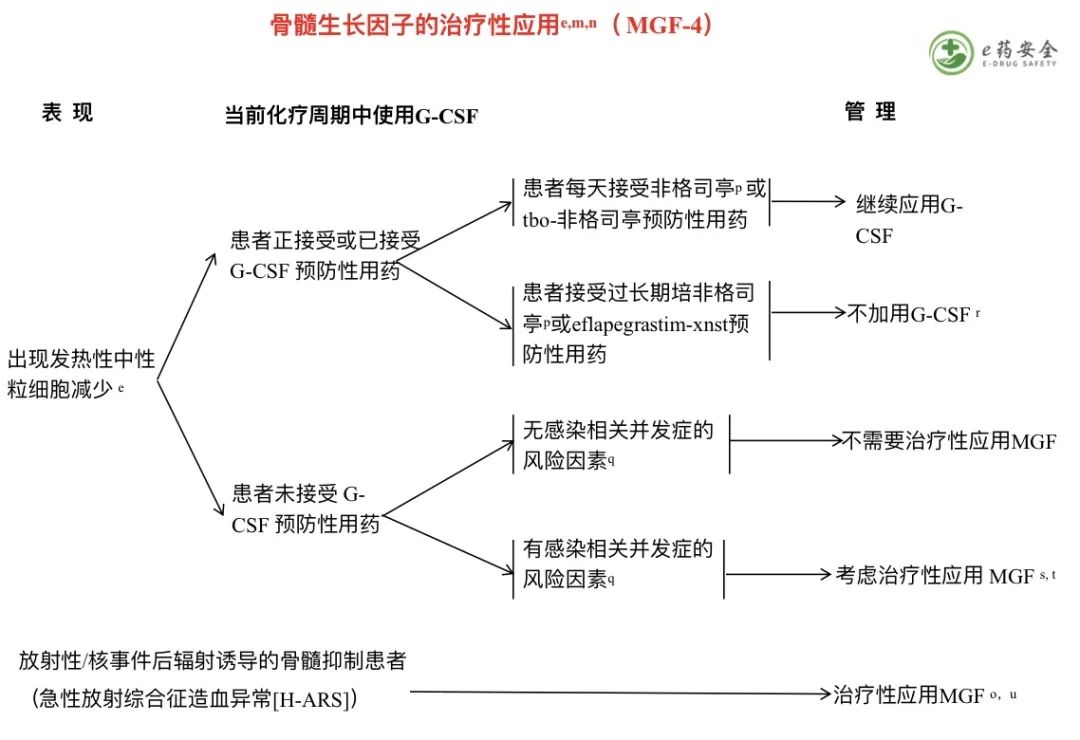





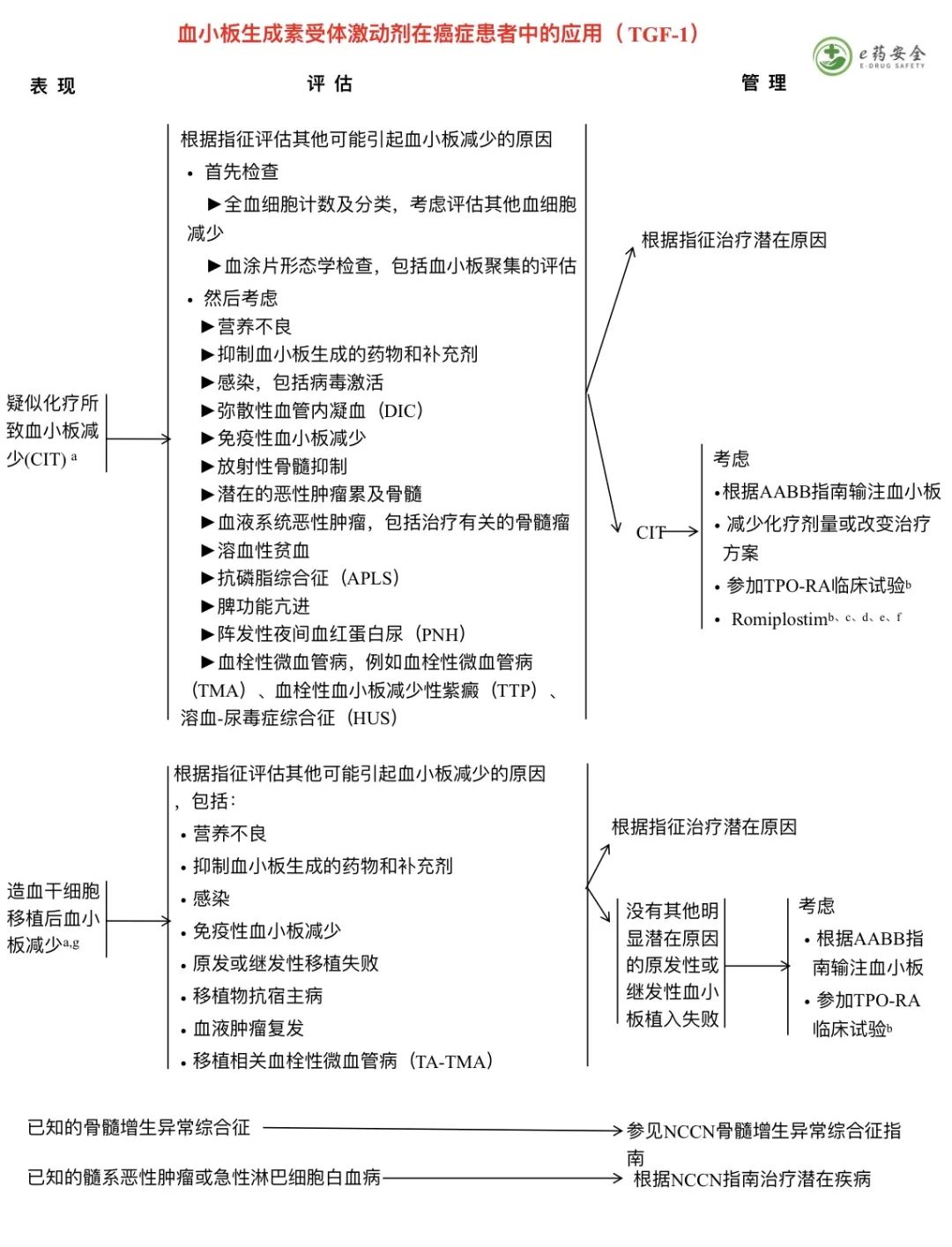
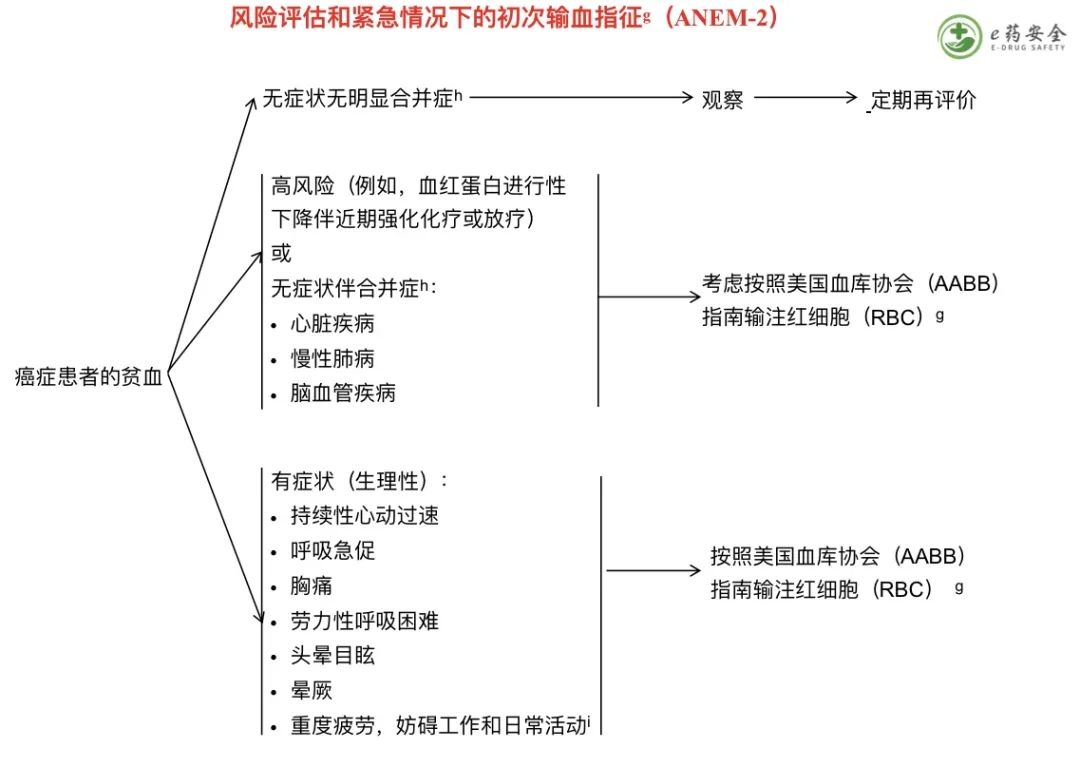
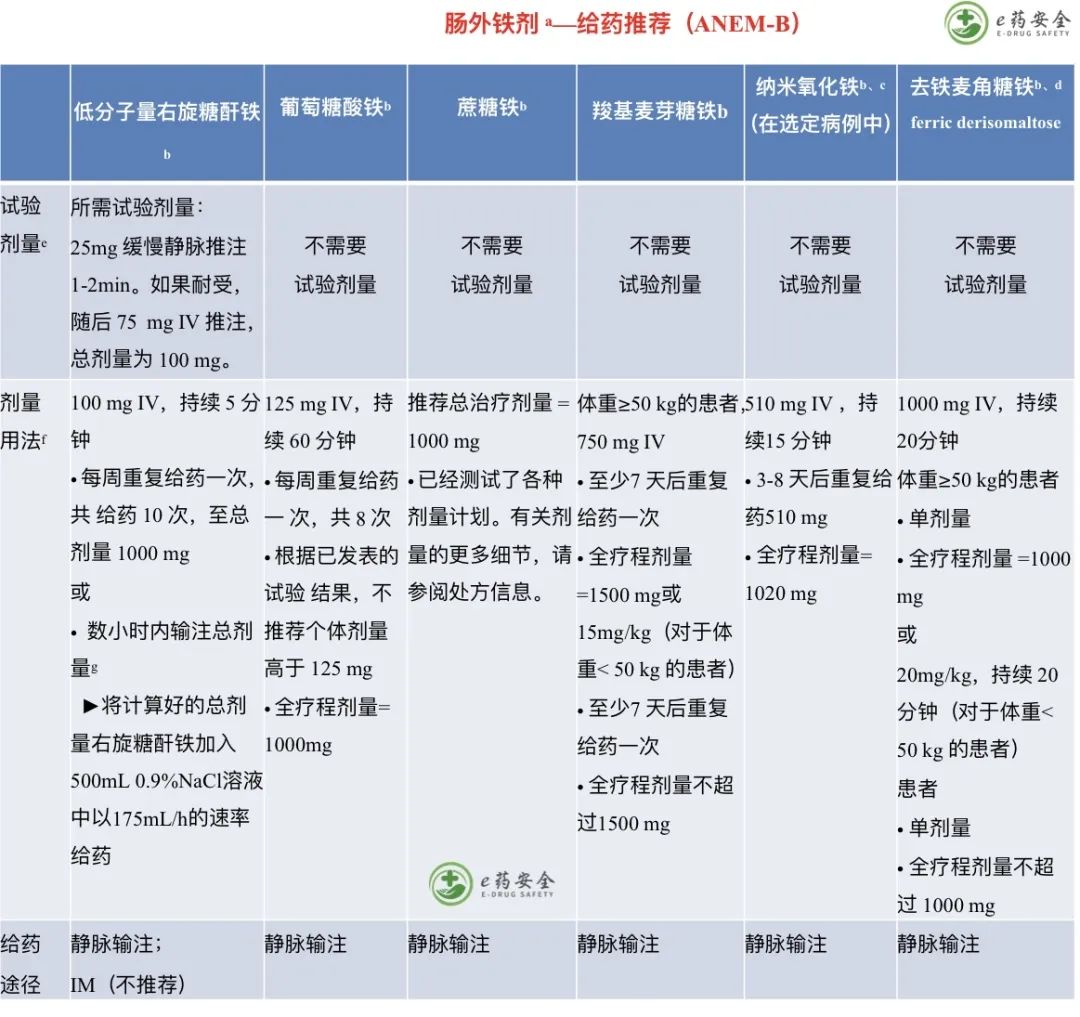
g. 美国血库协会(AABB)已经制定了关于红细胞(RBC)输注适应症的推荐。详见“讨论”。
h. 当开始输注红细胞时,应考虑合并症的严重程度和贫血的严重程度。
i. 癌症治疗功能评估(FACT)系统中的乏力(FACT-F)和贫血(FACT-An)分量表和简明疲劳量表(BFI)是评估患者报告乏力的标准化测量工具的范例。
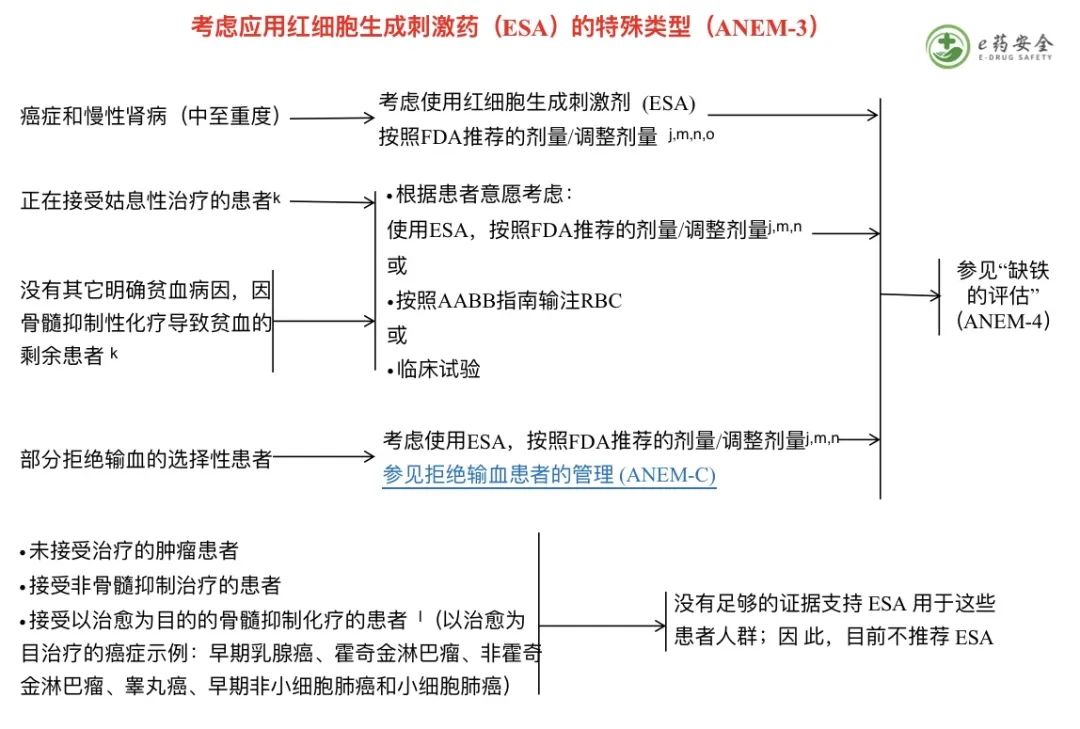
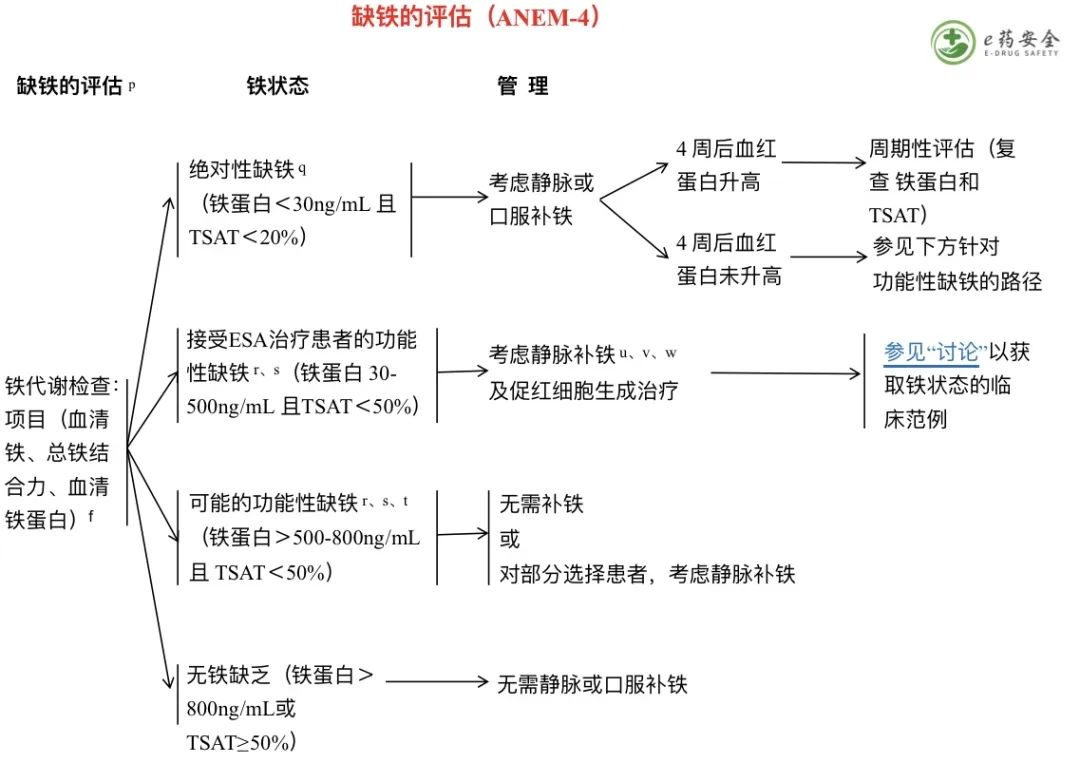



本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言