FDA批准pembrolizumab作为高表达PD-L1转移性NSCLC的一线治疗
2016-10-26 MedSci MedSci原创
FDA批准pembrolizumab作为表达PD-L1的转移性非小细胞肺癌的一线治疗药物。该药物适用于无EGFR或ALK基因异常、高PD-L1表达(肿瘤比例分数50%)和之前没有接受系统化疗的转移性非小细胞肺癌患者。剂量为每三周200毫克,直至疾病进展、出现不可接受的毒性、或24个月患者无疾病进展。两项随机对照试验表明,随机分配到pembrolizumab组的患者与化疗组患者相比,PFS和OS均得
FDA批准pembrolizumab作为表达PD-L1的转移性非小细胞肺癌的一线治疗药物。
该药物适用于无EGFR或ALK基因异常、高PD-L1表达(肿瘤比例分数50%)和之前没有接受系统化疗的转移性非小细胞肺癌患者。
剂量为每三周200毫克,直至疾病进展、出现不可接受的毒性、或24个月患者无疾病进展。
两项随机对照试验表明,随机分配到pembrolizumab组的患者与化疗组患者相比,PFS和OS均得到显著改善。
一项试验纳入305例之前没有接受系统化疗、高PD-L1表达、转移性NSCLC患者,接受pembrolizumab治疗,与铂类为基础的化疗患者比较,中位数PFS更长(10.3 个月 vs. 6 个月; HR = 0.5; 95% CI, 0.37-0.68)。
此外,一个预先设定的中期分析显示,pembrolizumab可改善患者的OS(HR = 0.6;95% CI,0.41-0.89)。
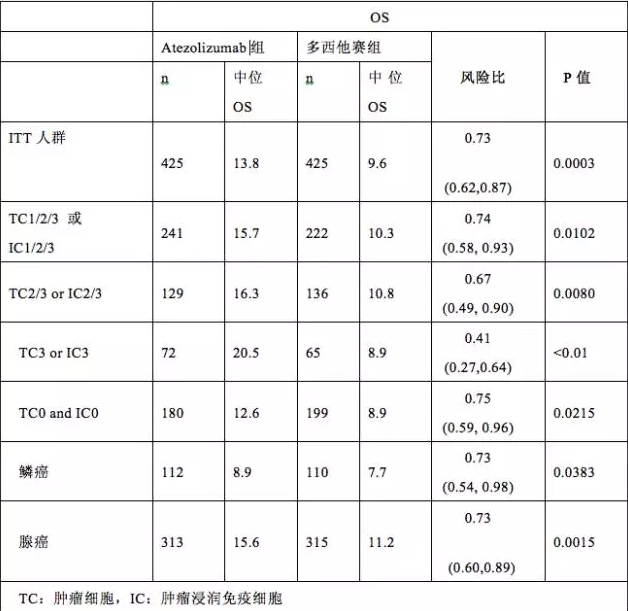
一项纳入1033例表达PD-L1的肿瘤细胞至少1%、转移性NSCLC患者,结果表明,与多西他赛组(8.5个月)患者比较,pembrolizumab 2-mg/kg每三周组患者的生存延长(10.4 个月; HR = 0.71; 95% CI, 0.58-0.88),10-mg/kg剂量组患者的生存也被延长(12.7 个月; HR = 0.61; 95% CI, 0.49-0.75)。
与pembrolizumab相关的最常见的不良反应包括食欲下降、乏力、恶心、呼吸困难、咳嗽、便秘。严重不良事件很少发生,包括免疫介导性肺炎、肠炎、肝炎、肾炎、内分泌疾病。
原始出处:
FDA approves Keytruda for first-line treatment of PD-L1–expressing metastatic NSCLC.Healio.October 25, 2016
本网站所有内容来源注明为“梅斯医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于梅斯医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“梅斯医学”。其它来源的文章系转载文章,或“梅斯号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言











#Pembro#
74
#mAb#
52
#PE#
71
#转移性NSCLC#
55
#FDA批准#
68
谢谢分享!
117
谢谢分享!
123
#PD-L1#
62
#Pembrolizumab#
61
#转移性#
68